Síntese de peptídeos
Um peptídeo é composto por dois ou mais aminoácidos ligados por uma ligação amida, formando uma cadeia de aminoácidos com um comprimento típico de 2-70 aminoácidos. Os peptídeos diferem das proteínas por não precisarem passar pelo processo de enovelamento para terem atividade biológica. Peptídeos podem ocorrer de forma endógena como hormônios peptídicos, como a angiotensina, LHRH, encefalina, e como toxinas em plantas e animais. Os peptídeos são de grande interesse como compostos-guia para a descoberta de medicamentos e também podendo ser eles próprios medicamentos. Eles também têm aplicação em vacinas, biomateriais, sondas histológicas e são usados em grandes quantidades como antígenos para a geração de anticorpos.
Os peptídeos são sintetizados quimicamente em solução ou em fase sólida. Esse processo envolve a formação direcionada e seletiva de uma ligação amida entre um aminoácido protegido por um grupo N e um aminoácido com um grupo amina livre e o ácido carboxílico protegido. Na síntese em fase sólida, o grupo que protege a carboxila é ligado a um polímero de suporte. Após a formação da ligação, o grupo protetor da amina do dipeptídeo é removido, e o próximo aminoácido com grupo N protegido é acoplado.
Categorias em destaque
Oferecemos uma ampla oferta de aminoácidos, resinas e reagentes de qualidade inigualável, incluindo Novabiochem®, para síntese de peptídeos, química orgânica de alto rendimento, marcação de peptídeos e produtos fabricados sob encomenda.
Nossos ligantes e complexos de NHC estáveis e toleráveis podem ser usados como ligantes auxiliares eficazes para manter o seu fluxo de trabalho na pesquisa em catálise organometálica e química catalítica.
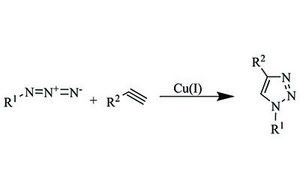
Nosso portfólio de reagentes para química "click" inclui diversas azidas, alcinos, catalisadores e ligantes para acelerar o seu progresso em biologia química, química de polímeros, bioconjugação e descoberta de medicamentos.
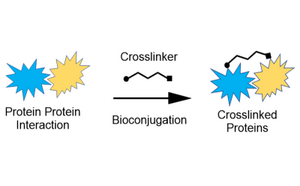
Nosso portfólio de ligantes e reticuladores oferece estabilidade estrutural e confiabilidade em interações proteicas, proteína-peptídeo e proteína/peptídeo-moléculas pequenas para todas as suas necessidades de bioconjugação.
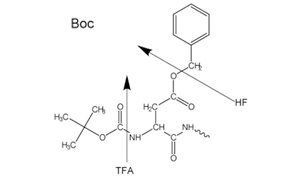
Figure 2Side-chain protecting groups for Boc solid-phase peptide synthesis (SPPS)
A síntese de peptídeos em fase sólida (SPPS) é o método mais comumente utilizado de síntese de peptídeos devido à sua eficiência, simplicidade, rapidez e facilidade de paralelização. A SPPS envolve a adição sequencial de resíduos de aminoácidos e de aminoácidos com cadeias laterais protegidas a um aminoácido ou peptídeo ligado a um suporte polimérico insolúvel (Figura 1).
A N-α-proteção é feita utilizando um grupo Boc suscetível a ácidos (Boc SPPS) ou um grupo Fmoc suscetível a bases (Fmoc SPPS). Após a remoção desse grupo protetor, o próximo aminoácido protegido é adicionado utilizando um reagente de acoplamento ou um derivado de aminoácido protegido pré-ativado. O aminoácido C-terminal é ancorado à resina por um ligante, cuja natureza determina as condições necessárias para a liberação do peptídeo do suporte após o alongamento da cadeia. Os grupos protetores de cadeias laterais costumam ser escolhidos de modo a serem clivados simultaneamente com o desprendimento do peptídeo da resina (Figura 2 e 3).
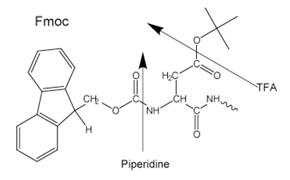
Figure 3.Side-chain protecting groups for Fmoc solid-phase peptide synthesis (SPPS)
A maioria dos peptídeos é preparada usando o método com Fmoc no qual a clivagem final e desproteção é realizada através do tratamento com ácido trifluoracético, diferentemente do método com Boc, que requer o uso de equipamento especializado com ácido fluorídrico (HF) anidro líquido, que é altamente corrosivo e tóxico.
Peptídeos de 50 aminoácidos podem ser preparados de forma rotineira, embora a síntese de proteínas com mais de 100 aminoácidos seja frequentemente relatada. Proteínas mais longas podem ser preparadas através da ligação química nativa de peptídeos totalmente desprotegidos em solução. Com essa metodologia, é possível sintetizar peptídeos naturais que são difíceis de serem expressos em bactérias, ou incorporar aminoácidos não naturais ou D-aminoácidos, e gerar peptídeos cíclicos, ramificados, marcados e com modificações pós-tradução.
A síntese de peptídeos em fase líquida que, em geral, utiliza proteção com Boc ou Z-amino, foi suplantada pela síntese de peptídeos em fase sólida, exceto para casos de processos existentes de síntese de peptídeos em larga escala para fins industriais.
Visite nossa busca de documentos para obter folhas de dados, certificados e documentação técnica.
Artigos relacionados
- Novabiochem® has one of the most extensive ranges of linkers and derivatized resins for Fmoc solid phase peptide synthesis. These resins have varied properties with special protocols for loading and cleaving.
- Chromogenic and fluorogenic derivatives are invaluable tools for biochemistry, having numerous applications in enzymology, protein chemistry, immunology and histochemistry.
- Aspartimide formation 1,2 is caused by repeated exposure of aspartic acid-containing sequences to bases like piperidine and can result ultimately in the generation of 9 different by-products.
- The Novabiochem® product line has one of the most extensive ranges of polymer-supports for solid phase peptide synthesis. They range from high-loaded, lows welling for the large-scale production of relatively short peptides to high-swelling, low-loaded for the synthesis of long or difficult sequences.
- Our long peptide purification utilizes a combination of chemoselective purification tags and standard RP-HPLC. The method is especially effective at removing impurities that are closely eluting or hidden under the isolated product peak
- Ver todos (25)
Protocolos relacionados
- A guide to create solvent systems used for the thin-layer chromatography assay of Novabiochem products.
- Overcome challenges in synthesis and disulfide bond formation with protocols for Fmoc solid-phase peptide synthesis of peptides with cysteine and methionine.
- Amide Coupling in a Box
- Information on the Amide bond and the Catalytic Amide Bond Formation Protocol. Amidation of amines and alcohols. The amide bond, an important linkage in organic chemistry, is a key functional group in peptides, polymers, and many natural products and pharmaceuticals.
- We provide an overview of our available reagents, together with recommendations and details of their use for synthesis of peptides containing post-translationally modified amino acids.
- Ver todos (10)
Encontre mais artigos e protocolos
Como podemos ajudar
Em caso de dúvidas, envie uma solicitação de suporte ao cliente
ou fale com nossa equipe de atendimento ao cliente:
Envie um e-mail para custserv@sial.com
ou ligue para +1 (800) 244-1173
Assistência adicional
- Chromatogram Search
Use the Chromatogram Search to identify unknown compounds in your sample.
- Calculadoras e aplicativos
Conjunto de ferramentas na Web - ferramentas e recursos científicos de pesquisa para química analítica, ciências biológicas, síntese química e ciências de materiais.
- Customer Support Request
Selecione uma opção abaixo e preencha o formulário para contatar os nossos especialistas em assistência.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
Para continuar lendo, faça login ou crie uma conta.
Ainda não tem uma conta?