Charakterisierung von Biopharmazeutika

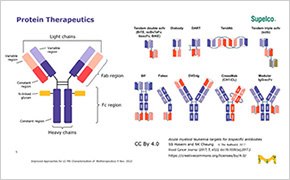
Biopharmazeutika sind Arzneimittel, die mit biotechnologischen Methoden hergestellt werden. Dazu gehören monoklonale Antikörper (mAb), therapeutische Proteine, Fusionsproteine, Antikörper-Wirkstoff-Konjugate und andere Biologika. Ziel der Charakterisierungsprüfung ist es, ein besseres Verständnis der physikalischen und chemischen Eigenschaften biopharmazeutischer Materialien zu erlangen. Bei der Entwicklung von Arzneimitteln können sich diese Eigenschaften auf die Leistung, die Verarbeitbarkeit, die Stabilität und das Aussehen des Produkts auswirken.
Ausgewählte Kategorien
Erreichen Sie präzise Trennvorgänge mit unserem umfassenden Angebot an HPLC-Säulen. Verbessern Sie Retention, Auflösung und Selektivität. Bestellen Sie noch heute!
Erkunden Sie unser Angebot an fortschrittlichen Zellkulturwerkzeugen für Forschung, Arzneimittelforschung und Herstellung. Von Medien bis hin zu Kulturgefäßenn – bei uns sind Sie rundum versorgt.
Browsen Sie durch unsere Protein-, Enzym- und Kleinmolekülprodukte für die Zellbiologie, Zellkultursupplementation und Signalweguntersuchungen.
Browsen Sie durch unsere Protein-, Enzym- und Kleinmolekülprodukte für die Zellbiologie, Zellkultursupplementation und Signalweguntersuchungen.
Charakterisierung und Analyse von Biologika und Biosimilars
Biologische Arzneimittel erfordern hochentwickelte analytische Arbeitsabläufe für ihre Analyse und Charakterisierung, wobei der Schwerpunkt auf der Einhaltung von GMP und regulatorischen Vorschriften liegt. Die Entwicklung sowohl einer originären biologischen Therapie als auch eines Biosimilars erfordert Studien zur Produktcharakterisierung, um ein robustes und gut spezifiziertes biologisches Arzneimittel zu erhalten.
Identität
Bestimmung der intakten Masse
Die Bestimmung der intakten Molekülmasse, die häufig mit SEC-MS und auf Basis geeigneter Standards durchgeführt wird, ist ein notwendiger Schritt bei der Charakterisierung von Biologika – von der Auswahl der Klone bis zur Überprüfung des Endprodukts. Die Analyse der intakten Molekülmasse wird üblicherweise verwendet, um die Vielfalt der Protein-/Peptidprodukte nachzuweisen und die Identität von Biologika zu überprüfen. Bei entsprechender Optimierung kann sie auch dazu eingesetzt werden, das intakte Molekulargewicht aller Proteinprodukte, einschließlich bispezifischer monoklonaler Antikörper, zu bestimmen.
Alternativ zur schwer zu handhabenden intakten Masse eines großen Biomoleküls wird ein Ansatz zur Proteinverdauungsanalyse verwendet, bei dem die Probe zunächst in wenige Fragmente aufgespalten wird, woraufhin die Separation einzeln mit spezialisierten Massenspektrometrie-Proteomikstandards durchgeführt werden kann.
Titermessung
Die Fähigkeit der Zelllinie, ausreichende Mengen monoklonaler Antikörper zu produzieren, bestimmt ihr wirtschaftliches Potenzial. Als Ausgangsmessung wird der Titer mittels Protein-A-Affinitätschromatographie (HPLC) gemessen. Zu Beginn der Entwicklung eines mAb sollte eine große Anzahl von Erntezellkulturproben (HCC) auf IgG-Titer untersucht werden. Die Affinitätschromatographie mit einem Protein-A-Liganden wird häufig zur Bestimmung der mAb-Konzentration und zur Aufreinigung für die Aggregat- und Ladungsvariantenanalyse im Downstream-Prozess verwendet.
Aminosäureanalyse
Die Aminosäureanalyse ist eine gängige Methode zur Feststellung der Produktidentität und wird zur Bestimmung der Aminosäurezusammensetzung eines mAb eingesetzt. Sie wird häufig zusammen mit einer Messung des Extinktionskoeffizienten durchgeführt, einer Methode, die routinemäßig zur Bestimmung des Titers zwischen verschiedenen Produktionsläufen eingesetzt wird.
Zertifizierte Referenzmaterialien mit Werten, die durch metrologisch gültige Verfahren zugewiesen werden, sind entscheidend für die Minimierung und Kontrolle von Versuchsvariationen in allen Schritten des Arbeitsablaufs der Aminosäureanalyse, einschließlich Proteinextraktion, Fraktionierung, Anreicherung, Proteolyse und Analyse.
Peptidkartierung
Um einen Hinweis auf die Identität des mAb zu erhalten, kann der Vergleich von einfachen Peptidkartierungen einzelner Enzyme ausreichen. Eine detailliertere Charakterisierung therapeutischer Antikörper, einschließlich der N- oder C-terminalen Sequenzierung, der Charakterisierung von Glykanen und anderer Aspekte der Antikörperproduktion, -analyse, -aufreinigung und -fragmentierung kann aussagekräftigere Informationen für die Produktentwicklung liefern. Die Massenspektrometrie in der Proteomik liefert zusätzliche Strukturinformationen.
Posttranslationale Modifikationen
Analyse von N-Glykan
Eine hochgradig variable Glykosylierung kann die Reinheit von mAb beeinträchtigen und zu einer variablen Funktion führen. Monoklonale Antikörper tragen N-Glykane auf ihrem Backbone, die mittels LC-MS freigesetzt werden können, um die Glykosylierungsmuster zu bewerten. Die Charakterisierung der N-Glykane eines monoklonalen Antikörpers ist erforderlich, um vollständige strukturelle Details des untersuchten Moleküls zu erhalten. Das Verständnis dieser N-Glykan-Pfade ist wichtig, da N-Glykane viele Eigenschaften von Glykoproteinen beeinflussen, darunter ihre Konformation, Löslichkeit, Antigenität und Erkennung durch glykanbindende Proteine.
Vergleich monoklonaler Antikörper (mAb) mit Strukturen höherer Ordnung (HOS)
Viele Faktoren beeinflussen HOS – die 3D-Struktur eines mAb – angefangen bei der Wahl der Zelllinie für die mAb-Produktion bis hin zu den Bioprozessbedingungen wie Temperatur, pH-Wert und Lichtexposition. Die Wasserstoff-Deuterium-Austausch-Massenspektrometrie (HDX-MS) ist eine Methode, die einen detaillierten Einblick in die Tertiärstruktur des mAb ermöglicht.
Analyse der mAb-Modifikation
Während des mAb-Herstellungsprozesses können viele verschiedene posttranslationale Modifikationen auftreten, die stark von Prozessparametern wie Medien, Temperatur usw. beeinflusst werden. Um ein gleichbleibendes Produkt herzustellen, ist es entscheidend, dass diese Modifikationen bei jedem Durchlauf der mAb-Synthese reproduziert werden. Die Modifikationsanalyse umfasst die Kartierung von Disulfidbrücken und die Bewertung der Glykan-Grundstruktur. Es ist auch ratsam, die Sialylierung zu quantifizieren, da Sialinsäure einen negativen Effekt auf mAb haben kann.
mAb-Ladungsverteilung
Durch posttranslationale Modifikationen (PTM) oder chemische Modifikationen können Ladungsvarianten einen erheblichen Einfluss auf die biologische Aktivität und Pharmakokinetik eines mAb haben. Die Analyse von Ladungsvarianten, die für mAb gesetzlich vorgeschrieben ist, kann mit Methoden wie der Kationenaustauschchromatographie (CEX) und der Kapillar-isoelektrischen Fokussierung (cIEF) durchgeführt werden.
Physikalische Tests und Größenverteilung von mAb
Physikalische Prüfung von mAb
Physikalische Tests dienen der Charakterisierung des Erscheinungsbildes eines mAb und umfassen z. B. die Messung von pH-Wert, Osmolalität und Konzentration. Die Integrität der Verpackung wird ebenfalls im Rahmen des physikalischen Prüfprotokolls bewertet, zum Beispiel die Karl-Fischer-Feuchtigkeitsanalyse oder das Eindringen von Farbstoffen zur Bestätigung der Dichtigkeitsprüfung.
Größenverteilung von HmAb
Es wird zwar ein einheitliches mAb-Produkt angestrebt, doch enthält das ursprüngliche Produktionsmaterial häufig Varianten verschiedener Größe wie Aggregate, Fragmente und Biomoleküle, die zusätzliche leichte Ketten aufweisen. Da diese die Immunogenität und Wirksamkeit beeinträchtigen können, ist es wichtig, ihr Vorhandensein zu überwachen. Die Größenausschlusschromatographie (SEC) ist die am häufigsten verwendete Methode zur Bewertung der Größenverteilung.
Sterilität & Verunreinigungen
Verunreinigungen durch Wirtszellproteine
Verunreinigungen durch Wirtszellproteine (HCP), die in Biotherapeutika in ppm-Mengen vorhanden sind, stellen ein großes Immunogenitätsrisiko dar, da sie bei Patienten eine unvorhersehbare Immunreaktion auslösen können. Ihre komplexe und vielfältige Natur macht es schwierig, sie zu entdecken oder zu überwachen. Während die meisten HCP-Verunreinigungen in den üblichen Downstream-Aufreinigungsverfahren wirksam entfernt werden können, stellen einige wenige HCP eine besondere Herausforderung dar. Knockouts eines schwer zu entfernenden CHO-HCP, der Lipoproteinlipase, wurden entwickelt, um die Stabilität von Polysorbaten in monoklonalen Antikörperformulierungen zu verbessern.
Überwachung von Herstellungszusätzen
Während der Entwicklung und Herstellung von mAb muss eine Vielzahl von Herstellungszusätzen überwacht werden, darunter Detergenzien, Protein A, Transfektionsreagenzien, Antibiotika, Entschäumer und Wachstumsfaktoren.
Mikrobielle Prüfung von mAb
Für die GMP-konforme Entwicklung und Herstellung von Arzneimitteln ist eine Vielzahl von mikrobiologischen Prüfverfahren erforderlich. Viele mAb werden in Mikroorganismen hergestellt, um sich deren hohe Wachstumsraten und Ausbeuten zunutze zu machen. Aus diesem Grund ist das Monitoring und die Kontrolle mikrobieller Verunreinigungen von entscheidender Bedeutung. Ein Bestandteil der Zellwand gramnegativer Bakterien, das sogenannte Endotoxin, ruft Reaktionen hervor, die von Fieber und Schüttelfrost bis hin zu einem tödlichen septischen Schock reichen. Daher sind der Nachweis von Pyrogenen (MAT-In-vitro-Tests) und deren anschließende Entfernung aus dem mAb essenziell und auch gesetzlich vorgeschrieben. Keimbelastungsprüfungen sollten während des gesamten mAb-Herstellungsprozesses durchgeführt werden, um zu überwachen, ob eine potenziell schädliche mikrobielle Kontamination vorliegt. Sterilitätsprüfungen sind ebenfalls wichtig, um die Integrität der mAb-Produktion zu bestätigen.
Besuchen Sie unsere Dokumentensuche, wo Sie Datenblätter, Zertifikate und technische Dokumentation finden.
Zugehörige technische Artikel
- A complete SEC-UV workflow for the characterization of mAb monomers, aggregates, and fragments using Zenix® and Zenix®-C SEC columns, including system suitability testing and forced pH and temperature stress studies.
- Optimization of a Reversed-Phase Liquid Chromatographic (RP-LC) method for the intact analysis of a therapeutic monoclonal antibody, trastuzumab, using a BIOshell™ A400 Protein C4 column.
- Explore various strategies for deglycosylating N-linked glycans involving PNGase F, PNGase A (Glycopeptidase A), and even native and sequential deglycosylation with endoglycosidases like Endoglycosidase H, Endoglycosidase F, and exoglycosidases.
- Comparative analysis of different columns in resolving medium-sized fragments of monoclonal antibodies, after digestion using dithiothreitol (DTT) or IdeS (a protease), by Reversed-Phase Chromatography.
- Step-by-step workflows for the intact mass analysis, peptide mapping, and N-glycan analysis of the monoclonal antibody― adalimumab, for an accurate characterization of the critical quality attributes (CQAs) to ensure drug safety and efficacy. Read more.
- Alle anzeigen (17)
Zugehörige Protokolle
- An optimized LC-MS/MS based workflow for low artifact tryptic digestion and peptide mapping of monoclonal antibody, adalimumab (Humira) using filter assisted sample preparation (FASP).
- A step-by-step protocol for released N-linked glycan analysis of the monoclonal antibody adalimumab, based on UHPLC-FLR-MS and procainamide labeling.
- A complete workflow for the intact and middle-up mass analysis of reduced and non-reduced monoclonal antibodies based on SEC-MS with sample preparation by protein-A affinity clean-up.
- BIOshell™ IgG 1000 Å C4 UHPLC Column for Improved Biomacromolecule Separations
- SigmaMab Antibody Drug Conjugate Mimic, is a non-toxic drug mimic utilized as a standard for mass spectrometry and high performance liquid chromatography.
- Alle anzeigen (5)
Mehr Artikel und Protokolle finden
Webinare zu diesem Thema
Dieses Webinar befasst sich mit grundlegenden Ansätzen der Chromatographie für die Intakt- und Middle-up-Analyse von mAb, bevor detailliertere und komplexere Analysestrategien behandelt werden.
Webinar: Tips for Improved Peptide Mapping
In diesem Webinar werden die Fortschritte in der „Bottom-up“-Analyse monoklonaler Antikörper erörtert, wobei die Rolle und Bedeutung der Säulenchemie bei der Entwicklung hochselektiver Hochleistungsflüssigkeitschromatographie (HPLC)-Methoden für Peptide hervorgehoben wird.
In diesem Webinar werden innovative Methoden aufgezeigt, um die Präzision bei der Charakterisierung von Biotherapeutika zu verbessern und das Prozessverständnis zu vertiefen.
Wie wir weiterhelfen können
Sollten Sie Fragen haben, reichen Sie bitte eine Anfrage beim Kundensupport
ein oder sprechen Sie mit unserem Kundenservice:
E-Mail custserv@sial.com
oder telefonisch unter +1 (800) 244-1173
Weitere Unterstützung
- Chromatogram Search
Use the Chromatogram Search to identify unknown compounds in your sample.
- Rechner & Apps
Web-Toolbox - wissenschaftliche Forschungstools und Informationsquellen für die Bereiche analytische Chemie, Life Science, chemische Synthese und Materialwissenschaft.
- Customer Support Request
Customer support including help with orders, products, accounts, and website technical issues.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?