Pull-down di proteine
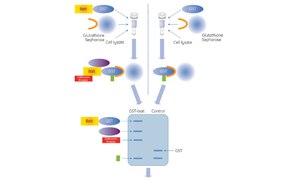
Il saggio di pull-down è stato concepito per determinare l'interazione tra due o più proteine. Nel pull-down per affinità, una proteina con tag detta “esca” (bait) viene catturata da un ligando immobilizzato covalentemente a un supporto; in alternativa l’esca è legata per affinità a ioni metallici, come nella cromatografia di affinità per metalli (IMAC). I tag di fusione più comunemente usati per le esche sono la glutatione S-transferasi (GST) e l'istidina. La proteina esca forma un complesso che è poi incubato con le proteine contenute in un lisato di cellule o tessuti. Attraverso una serie di lavaggi, le proteine di interesse vengono eluite dal supporto e raccolte per centrifugazione. La tecnica del pull-down per affinità per la purificazione e rilevazione delle proteine si distingue dal saggio di immunoprecipitazione (IP) e dalla Co-IP in quanto non si avvale di una interazione antigene-anticorpo. Nei saggi di pull-down, il campione purificato viene poi spesso sottoposto a ulteriori analisi mediante SDS-PAGE, spettrometria di massa e Western blotting.
Categorie in evidenza
Nel campo della scienza e della medicina, le tecnologie Cytiva™ hanno reso possibili enormi passi in avanti, che hanno contribuito a dare forma all’odierna industria delle biotecnologie.
Ottimizzate la purificazione delle proteine con il nostro assortimento di resine e di tamponi ideali per svariati tag...
Resine con streptavidina e avidina e colonne pre-impaccate per la purificazione su piccola scala e su larga scala...
Applicazioni del pull-down per affinità con GST
La glutatione S-transferasi (GST) è una proteina di 211 amminoacidi che si trova nella maggior parte degli organismi. La GST viene spesso inserita nei vettori di espressione ai fini della produzione di proteine di fusione con tag GST in sistemi di espressione come gli E. coli. Il tag-GST è un tag proteico di grandi dimensioni, circa 26 kDa, e può essere espresso in cellule di batteri, lieviti, mammiferi e insetti. L’uso di un tag GST è vantaggioso quando è necessario proteggere la proteina ricombinante dall’azione delle proteasi intracellulari o aumentarne la solubilità. Inoltre, la proteina-GST include un tag ad alta affinità che agevola la purificazione e gli esperimenti di pull-down con l'impiego di resine di affinità poco costose in condizioni di eluizione blande.
Co-immunoprecipitazione
Il saggio di pull-down è ideale per verificare i risultati della co-immunoprecipitazione ed è un metodo eccellente per identificare interazioni proteina-proteina sconosciute oltre che lo stato di attivazione di determinate proteine. A differenza dei metodi di pull-down basati sull’affinità, l'IP si avvale di anticorpi per legare e isolare gli antigeni da campioni biologici complessi.
Nella Co-IP, un anticorpo lega un antigene all'interno di un complesso multiproteico. Il complesso viene quindi catturato con l'aggiunta di proteina A o proteina G legate a un supporto. L'elevata affinità delle proteine A/G per la regione Fc degli anticorpi IgG policlonali e monoclonali le rende un componente critico nella purificazione di proteine o di complessi proteici di interesse. Il metodo del pull-down costituisce uno strumento essenziale per lo studio delle reti di interazione proteina-proteina; tuttavia, la scelta del metodo specifico sarà determinata dalla specifica esigenza applicativa del ricercatore.
Fate una ricerca tra i numerosi documenti disponibili: schede tecniche, certificati e documentazione tecnica.
Articoli tecnici correlati
- Differential centrifugation and density gradient centrifugation are two types of centrifugal techniques for separating particles.CsCl gradient centrifugation, or Caesium chloride centrifugation is used to make solutions for the separation of RNA from DNA by density gradient centrifugation.
- Centrifugation enables the separation of particles by sedimentation. Learn how to separate particles using a centrifuge and how to use Stokes' law to calculate the velocity of sedimentation.
- Sera-Mag and Sera-Mag SpeedBeads provide cost effective magnetic bead separation technology for molecular biology applications, nucleic acid isolation, and research immunoassays.
- Agarose beads Vs. Magnetic beads in Chromatin Immunoprecipitation (ChIP)
- This page describes immunoprecipitation (immunoaffinity or pull-down techniques).
- Visualizza tutto (10)
Protocolli correlati
- To determine the molecular weights of protein antigens, to study protein/protein interactions, to determine specific enzymatic activity, to monitor protein post-translational modifications and to determine the presence and quantity of proteins.
- Immunoprecipitation Kit (Protein G) Protocol & Troubleshooting
- Immunoprecipitation Kit (Protein A) Protocol & Troubleshooting
- Sera-Mag SpeedBeads Protein A/G Magnetic Particles provide a fast and convenient method for both manual and automated magnetic isolation of proteins using affinity binding. The particles can be used for isolating antibodies from serum, cell culture supernatant or ascites, and for immunoprecipitation and co-immunoprecipitation of antigens from cell or tissue extracts.
- The following material related to Nanodisc Technology is adapted from on-line content of the research group of Professor Stephen Sligar of the University of Illinois at Urbana-Champaign, with the kind permission of Professor Sligar.
- Visualizza tutto (14)
Per consultare altri articoli e protocolli
Come possiamo aiutarvi
Per qualunque domanda, non esitate a inviare una richiesta di assistenza
o a chiamare il nostro Servizio Clienti:
Email custserv@sial.com
telefono +1 (800) 244-1173
Altre risorse
- Chromatogram Search
Use the Chromatogram Search to identify unknown compounds in your sample.
- Strumenti di calcolo e app
Strumenti e risorse scientifiche online per la chimica analitica, le life science, la sintesi chimica e la scienza dei materiali.
- Customer Support Request
Assistenza clienti inclusa assistenza per ordini, prodotti, account e problemi tecnici del sito web.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
Per continuare a leggere, autenticati o crea un account.
Non hai un Account?