Hodowla organoidów 3D: Nowe modele rozwoju i chorób In Vitro
Systemy modeli komórkowych 2D vs. 3D
Systemy modelowe napędzają badania biologiczne poprzez odtwarzanie procesów i funkcji organizmu od poziomu molekularnego do poziomu całego organizmu. Ciało ludzkie składa się zarówno z materiału komórkowego, jak i niekomórkowego zorganizowanego w wysoce wyspecjalizowany sposób. Trudno jest naśladować wszystkie aspekty ludzkiej biologii za pomocą jednego in vitro systemu modelowego.Hodowle komórkowe 3D są dokładniejszym odwzorowaniem naturalnego środowiska, którego doświadczają komórki w żywym organizmie, w przeciwieństwie do hodowli komórek na płaskich powierzchniach 2D.
.
Czym są organoidy?
Organoidy to in-vitro powstałe agregaty komórek 3D pochodzące z tkanki pierwotnej lub komórek macierzystych, które są zdolne do samoodnowy, samoorganizacji i wykazują funkcjonalność narządów.3 Organoidy rozwiązują ograniczenia istniejących systemów modelowych, zapewniając:
- Podobny skład i architekturę do tkanki pierwotnej: Organoidy zawierają niewielką populację samoodnawiających się komórek macierzystych, które mogą różnicować się w komórki wszystkich głównych linii komórkowych, z podobną częstotliwością jak w warunkach fizjologicznych.
- Relewantne modele in-vivo warunki: Organoidy są bardziej biologicznie istotne dla każdego systemu modelowego i są podatne na manipulowanie składnikami niszy i sekwencją genów.
- Stabilny system do rozszerzonej hodowli: Organoidy mogą być kriokonserwowane jako biobanki i rozszerzane w nieskończoność poprzez wykorzystanie samoodnowy, zdolności różnicowania komórek macierzystych i wewnętrznej zdolności do samoorganizacji.

Rysunek 1.Organoidy nabłonka jelitowego myszy. Organoidy 3D zostały wygenerowane z tkanki jelitowej dorosłych myszy zgodnie z protokołem opisanym przez Clevers et al. Science. 2013. Komórki organoidalne zaczynają tworzyć lumeny i struktury pąków około 3-5 dnia w hodowli i tworzą złożone struktury podobne do krypt około 7-10 dnia. Te kryptopodobne domeny są funkcjonalnie podobne do tych w dorosłym jelicie, gdzie dzielące się jelitowe komórki macierzyste LGR5+ są interkalowane z komórkami Paneth znajdującymi się u podstawy krypty.
Organoidy a sferoidy
Organoidy i sferoidy to komórki hodowane w 3 wymiarach. Sferoidy są często tworzone z linii komórek nowotworowych lub biopsji guza jako swobodnie pływające agregaty komórek w płytkach o bardzo niskim poziomie przyczepności, podczas gdy organoidy pochodzą z komórek macierzystych tkanek osadzonych w matrycy hydrożelowej ECM, takiej jak Matrigel. Organoidy są bardzo złożone i bardziej przypominają in vivo w porównaniu do sferoidów. Ostatnio wykazano, że organoidy nowotworowe pozwalają przewidzieć, jak dobrze pacjenci reagują na leki przeciwnowotworowe, aby pomóc w spersonalizowanej medycynie.

Rysunek 2.Organoidy a sferoidy. Organoidy pochodzące z komórek macierzystych mają bardziej zbliżone do żywych fenotypy z wyższym poziomem złożoności tkanek w porównaniu do sferoidów nowotworowych.
Jak generowane są organoidy?
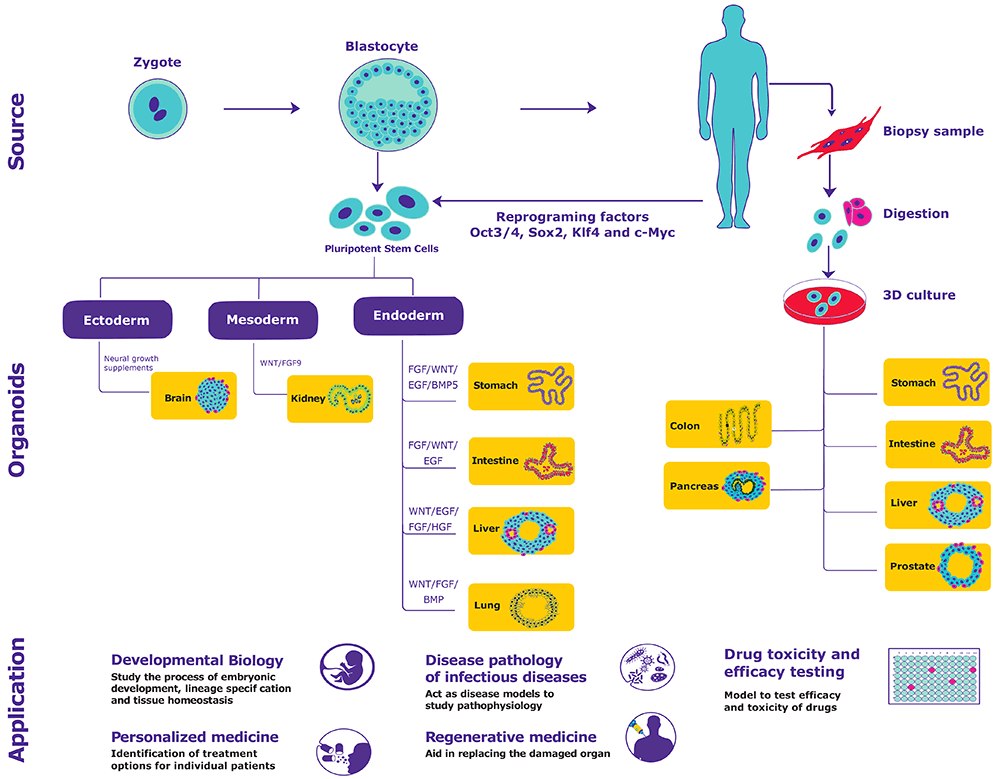
Organoidy są generowane z pierwotnych tkanek lub pluripotencjalnych komórek macierzystych (indukowanych pluripotencjalnych komórek macierzystych (iPSC) lub embrionalnych komórek macierzystych (ESC)) poprzez zapewnienie odpowiednich fizycznych i biochemicznych wskazówek4.
Wskazówki fizyczne: Zapewniają wsparcie dla przyczepienia i przetrwania komórek. Przykłady obejmują kolagen, fibronektynę, entaktynę i lamininę.
Wskazówki biochemiczne: Modulują szlaki sygnałowe, wpływając w ten sposób na proliferację, różnicowanie i samoodnowę. Przykłady obejmują EGF, FGF10, HGF, R-chondynę, WNT3A, kwas retinowy, inhibitory GSK3β, inhibitory TGF-β, inhibitory HDAC, inhibitory ROCK, Noggin, aktywinę A, inhibitory p38 i gastrynę.
Kwalifikowane odczynniki Organoid
Zastosowania organoidów
Organoidy są fizjologicznie istotne i podatne na analizy molekularne i biologiczne komórek, co jest bardzo obiecujące zarówno w badaniach podstawowych, jak i zastosowaniach translacyjnych.
Biologia rozwojowa
Organoidy pochodzące z ESC, iPSC zachowują cechy ich stadium rozwojowego i pomagają w badaniu procesu rozwoju embrionalnego, specyfikacji linii i homeostazy tkanek. Rzucają również światło na rozwój komórek macierzystych i ich nisz.
- Rozwój narządów takich jak mózg24, trzustka25 i żołądek7 był badany poprzez sekwencyjne etapy różnicowania indukowane przez modulowanie szlaków sygnałowych Wnt, BMP i FGF<< /li>
Patologia chorób zakaźnych
Organoidy reprezentują wszystkie składniki narządów i nadają się do badania chorób zakaźnych wpływających na wyspecjalizowane typy komórek ludzkich.
- Organoidy płucne pochodzące z iPSC od zdrowego dziecka niosącego zerowe allele genu czynnika regulacyjnego interferonu 7 stosowane do badania replikacji wirusa grypy 26
- Organoidy przodomózgowia pochodzące z ludzkich iPSC zostały wykorzystane do badania infekcji wirusem zika na progenitorach neuronalnych27
Medycyna regeneracyjna
Transplantacja organoidów pochodzących z dorosłych komórek macierzystych pomaga w zastąpieniu uszkodzonego narządu lub tkanki. Ponadto, możliwość korekcji genów za pomocą technologii CRISPR/Cas9 może być wykorzystywana w leczeniu monogenowych chorób dziedzicznych.
- Organy jelita cienkiego zachowały cechy jelita cienkiego, takie jak tworzenie kosmków i obecność kosmków Panetha po przeszczepieniu w modelach mysich28
.Testowanie toksyczności i skuteczności leków
Możliwość testowania skuteczności i toksyczności leków przeciwko reprezentatywnym celom/organom (jelitom, wątrobie i nerkom) może potencjalnie ograniczyć kwestie etyczne związane z wykorzystaniem zwierząt.
- Organoidy nerkowe Hymana zostały wykorzystane do wykazania nefrotoksyczności cisplatyny 11
Medycyna spersonalizowana
Organoidy pochodzące z dorosłych komórek macierzystych poszczególnych pacjentów umożliwiają testowanie ex vivo odpowiedzi na lek.
- Organoidy jelita grubego zostały wykorzystane do identyfikacji opcji leczenia dla pacjentów z rzadkimi mutacjami CFTR29
- Organy nowotworowe mogą być stosowane do oceny odpowiedzi na leki na poziomie indywidualnego pacjenta
Cultureware
Enzymy
Matryce organoidalne
Linie komórkowe
Podłoża i odczynniki hodowlane
Czynniki wzrostu i cytokiny
Małe cząsteczki
Odczynniki histologiczne
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?