Kontrole ładowania dla Western Blotting
Chandra Mohan, Ph.D., Wayne Speckmann, Ph.D, Robin Clark, Ph.D
Od czasu pierwszej publikacji opisującej Western blotting (Renart et al., 1979), ta technika immunodetekcji jest szeroko stosowana do identyfikacji specyficznych białek w złożonych mieszaninach ekstrahowanych z komórek lub tkanek. Western blotting składa się z trzech podstawowych elementów:1 oddzielenie białek według ich wielkości,2 przeniesienie na stałe podłoże oraz3 znakowanie białek docelowych przy użyciu odpowiedniego przeciwciała pierwszorzędowego, a następnie wizualizacja, zazwyczaj przy użyciu sprzężonego przeciwciała drugorzędowego. Późniejsze udoskonalenia narzędzi i technik - wraz z opracowaniem wysoce czułych etykiet fluorescencyjnych - znacznie zwiększyły granice wykrywalności i umożliwiły naukowcom badanie normalnych i chorobowych szlaków specyficznych dla tkanek. Jednak naukowcy zwykle napotykają pewne trudności podczas korzystania z ilościowego Western blottingu w celu identyfikacji zmian w poziomach białek. Wynika to z faktu, że wiele białek wykazuje różne wzorce ekspresji w różnych tkankach oraz w różnych warunkach fizjologicznych i patologicznych.
Western blotting: rutynowa technika, która nie jest prosta
Chociaż Western blotting jest prawdopodobnie najczęściej stosowaną aplikacją immunologiczną, nadal istnieje kilka krytycznych kwestii technicznych, które mogą być chronicznie pomijane. Na przykład, czy protokoły izolacji lub separacji wpływają na integralność białka lub jego modyfikację potranslacyjną? Czy można odróżnić degradację lub agregację białka od odpowiednich produktów procesów biologicznych? Gdy wynikiem jest wiele pasm, jak można określić, które z nich są wynikiem, zmiennością, artefaktem? (Gorr i Vogel, 2015)
Quantitative Western blot może być stosowany do porównywania względnych ilości białka docelowego w grupie próbek, które mogą reprezentować różne osoby, warunki leczenia, stany chorobowe lub inne zmienne biologiczne. Aby dokładnie zidentyfikować i zmierzyć całkowity poziom białka w wielu próbkach, naukowcy mogą użyć "kontroli obciążenia" jako wzorców wewnętrznych. Kontrola ta odnosi się do dodania pierwotnego przeciwciała przeciwko białku, o którym przypuszcza się, że jest obecne we wszystkich próbkach i na którego względną obfitość nie mają wpływu różnice biologiczne ani warunki eksperymentalne. Białka docelowe, które są zazwyczaj dobrymi kandydatami do kontroli obciążenia, są wszechobecnie wyrażanymi "utrzymującymi" produktami genowymi. Zastosowanie kontroli obciążenia pozwala na ilościowe określenie obciążenia próbki we wszystkich studzienkach w celu normalizacji wyników, przy założeniu, że kontrola obciążenia jest identyczna między różnymi pasami próbek. Zastosowanie kontroli obciążenia chroni również przed "efektem krawędzi", stanem często obserwowanym, gdy używana jest duża liczba pasów, a białka w zewnętrznych pasach przenoszą się na membranę w pozycji bliższej ramki, powodując bardziej intensywne zabarwienie na krawędzi blotu. Kontrole ładowania mogą być wykorzystane do wykazania, czy wystąpiła zmienność ładowania białek i mogą odpowiadać za obserwowane zmiany w pasmach docelowych. Prawidłowo stosowane kontrole ładowania zapewniają, że białka są odpowiednio oznaczane ilościowo pomimo subtelnych różnic w ilości ładunku na wszystkich pasach Western blot.
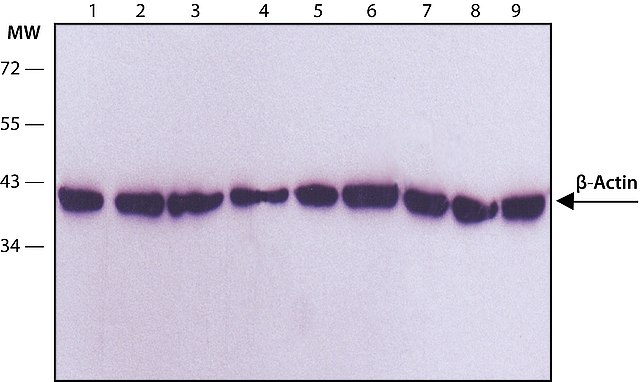
Walidacja Western blot przeciwciała monoklonalnego przeciwko β-aktynie (A5316). Białka o konstytutywnej ekspresji, takie jak β-aktyna, β-tubulina, GAPDH i inne są często wybierane jako kontrole obciążenia dla ilościowego Western blottingu. Zastosowanie kontroli ładowania pomaga zapewnić, że pozorne różnice w obfitości białka docelowego wynikają z odpowiedniej zmienności biologicznej, a nie z niespójności w ilości całkowitego białka załadowanego do żelu. W poniższej tabeli wymieniono inne przeciwciała specyficzne dla próbki i warunków, które są przydatne jako kontrole ładowania WB.
Wybór przeciwciał kontroli obciążenia
Beta-aktyna i beta-tubulina są konsekwentnie stosowane jako kontrole obciążenia, ponieważ ich ekspresja jest względnie konstytutywna w większości systemów modelowych.Niektóre publikacje kwestionują jednak zasadność stosowania β-aktyny jako standardowej kontroli obciążenia (Ditmar i Ditmar, 2006; Eaton et al., 2013; Li i Shen, 2013), ponieważ poziomy β-aktyny i β-tubuliny różnią się w zależności od tkanki, a na ich ekspresję mogą wpływać warunki patologiczne. Autorzy publikacji sugerują analizę całkowitego białka jako alternatywną technikę w ilościowym Western blottingu i zalecają, aby produkty genów "podtrzymujących" były stosowane ostrożnie po zbadaniu wzorca ekspresji badanego genu. Niemniej jednak, β-aktyna i β-tubulina oferują pewne zalety jako kontrole obciążenia: są one wysoce konserwowane, wykazują wysoki poziom ekspresji i wykazują stabilność w większości warunków eksperymentalnych. Ważne jest, aby pamiętać, że należy wybrać kontrolę w oparciu o konkretną badaną tkankę lub typ komórki, a testy empiryczne mogą być wymagane do zweryfikowania jednorodności kontroli obciążenia.
Wskazówki dotyczące uzyskiwania skutecznych wyników z przeciwciał kontroli ładowania
Aby przezwyciężyć zmienność w Western blotting i zmniejszyć błędy w interpretacji danych, pomocne mogą być niektóre z poniższych środków ostrożności.
- Używaj wewnętrznych kontroli ładowania, które są stabilnie wyrażane i na które warunki eksperymentalne mają minimalny wpływ.
- Wybierz przeciwciało kontroli ładowania przeciwko białku, o którym wiadomo, że ulega konstytutywnej ekspresji w próbce.
- Użyj drugiej kontroli ładowania, aby uzasadnić wyniki uzyskane dla pierwszej kontroli. Może to być szczególnie opłacalne w przypadku nowych lub nowych próbek.
- Kontrole ładowania powinny obejmować szeroki zakres mas cząsteczkowych, tak aby wybrana kontrola znajdowała się w podobnym zakresie MW, ale nie w tym samym MW co białko docelowe. Zapewnia to, że zarówno docelowe, jak i kontrolne pasma mogą być łatwo rozróżnione na blot.
- Przeciwciała kontroli ładowania często wykrywają białka podtrzymujące, które są obficie wyrażane, co prowadzi do nasycenia sygnału, szczególnie gdy stosowana jest chemiluminescencyjna metoda wykrywania. Nadmierne wysycenie może sprawić, że pasma kontroli ładowania będą bezużyteczne dla odniesienia, mogą ukrywać różnice w ilości białka docelowego między próbkami.
Zmierzyć stężenie przeciwciał i czas ekspozycji blotu kontroli ładowania z próbką, która ma być użyta przed rozpoczęciem, aby upewnić się, że sygnał kontroli ładowania mieści się w liniowym zakresie wykrywania.
Materiały
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?