Pyrogentests
Die Prüfung auf Pyrogene ist ein entscheidender Schritt, um die Sicherheit von parenteral verabreichten Medizinprodukten wie Pharmazeutika oder Biopharmazeutika zu gewährleisten. Er gehört zu den obligatorischen Freigabetests, um lebensbedrohliche Fieberreaktionen zu vermeiden, die durch pyrogene Substanzen ausgelöst werden. Der Monozyten-Aktivierungstest (MAT) kann sowohl Endotoxin- als auch Nicht-Endotoxin-Pyrogene in einem in vitro Test nachweisen.
Seit Juli 2025 ist der MAT laut Europäischem Arzneibuch die Methode der Wahl für den Nachweis von Endotoxinen und Nicht-Endotoxinen und hat den Kaninchen-Pyrogentest (RPT) ersetzt.
Products
Monozyten-Aktivierungstest (MAT)
Der MAT wird zum Nachweis von Endotoxinen und nicht endotoxischen Pyrogenen in parenteralen Produkten wie Arzneimitteln und Medizinprodukten verwendet und bietet eine in vitro eine Alternative zu herkömmlichen Tierversuchen in Übereinstimmung mit den gesetzlichen Richtlinien.
Der Kaninchen-Pyrogentest und der Limulus-Amöbozyten-Lysat (LAL)-Test werden allgemein zum Nachweis von Pyrogenen verwendet. Beide Methoden verwenden Tiere und weisen einige Einschränkungen auf. Dem Kaninchen-Pyrogentest mangelt es an Robustheit, da eine Tierreaktion stark von einer menschlichen Reaktion abweichen kann. Beim LAL-Test werden nur Endotoxine nachgewiesen, was ein Sicherheitsrisiko darstellt, da Nicht-Endotoxin-Pyrogene, die in der getesteten Probe vorhanden sein könnten, nicht berücksichtigt werden.
Um diese Einschränkungen zu überwinden, wurde der Monozyten-Aktivierungstest (MAT) 2010 als kompendiale Methode in das Europäische Arzneibuch aufgenommen, um den Kaninchen-Pyrogentest zu ersetzen (EP Kapitel 2.6.30) eingeführt und in den FDA-Leitlinien für die Industrie erwähnt.
Bitte beachten: Der European Pharmacopoeia Commission hat die Entscheidung getroffen, den Kaninchen-Pyrogentest in Übereinstimmung mit dem 3R-Prinzip abzuschaffen, da der MAT die beste Alternative darstellt.
Ab Juli 2025 ist der Kaninchen-Pyrogentest (RPT) in Europa verboten und das allgemeine Kapitel 2.6.8 über den Kaninchen-Pyrogentest wurde abgeschafft.

PyroMAT® in vitro Test zum Nachweis von Endotoxin und Nicht-Endotoxin-Pyrogenen
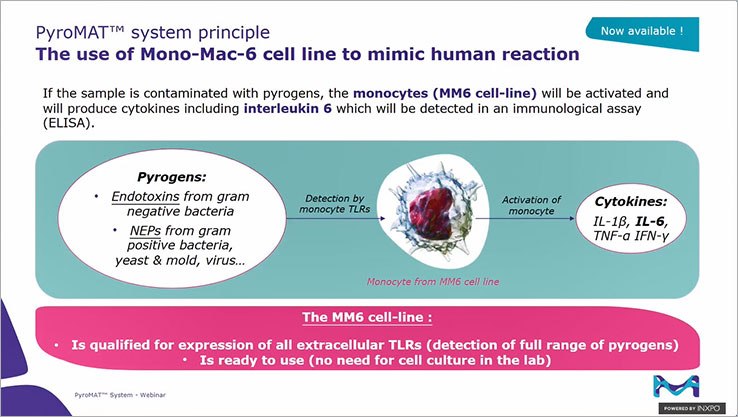
Das PyroMAT®-System basiert auf der Mono-Mac-6-Zelllinie und dem IL-6-Read-out. Es bietet alle Vorteile des Monozyten-Aktivierungstests in Kombination mit den Vorteilen der Verwendung einer Zelllinie.
- Nachweis eines breiten Spektrums von Pyrogenen: Die Patientensicherheit ist gewährleistet, wenn das gesamte Spektrum der Pyrogene getestet wird. Wie der Kaninchen-Pyrogentest (RPT) ist auch der MAT sowohl für den Nachweis von Endotoxinen als auch von Nicht-Endotoxinen geeignet.
- Erweiterung des Spektrums der zu testenden Produkte: die am häufigsten angewandten Methoden, RPT, Bakterieller Endotoxin-Test (BET) oder LAL, sind hinsichtlich der Produkttypen, die sie testen können, begrenzt. Der MAT bietet mehr Flexibilität hinsichtlich seiner Anwendungen.
- In vitro Test, der die menschliche Immunreaktion nachahmt: für ein robustes Vorhersagemodell, das den Tierverbrauch reduziert.
- Einhaltung internationaler Vorschriften und Richtlinien: im Einklang mit ethischen Trends der Industrie und der Aufsichtsbehörden zur Verringerung der Verwendung von Tierversuchen.
- Standardisierte Reaktivität und hohe Empfindlichkeit (LOD 0,05 EU/mL). Die Bequemlichkeit einer gebrauchsfertigen Zelllinie reduziert die mühsame Laborarbeit und macht ein Zellkulturlabor überflüssig.
- Qualifizierte Zellen: Mono-Mac-6-Zellen werden nicht nur bei der internationalen Validierung von MAT zitiert, sondern sind auch für die Expression aller Oberflächen-Toll-Like-Rezeptoren (TLRs) qualifiziert, um den Nachweis eines breiten Spektrums von Pyrogenen sicherzustellen.
Nicht-Endotoxin-Pyrogen-Positivkontrollen
Das Europäische Arzneibuch, Kapitel 2.6.30 (Monozyten-Aktivierungstest) verlangt, dass bei den vorbereitenden Tests mindestens der Toll-like-Rezeptor TLR4 und mindestens zwei weitere Toll-like-Rezeptor-Liganden nachgewiesen werden [...]. Die Auswahl der verwendeten Nicht-Endotoxin-Pyrogene sollte die wahrscheinlichste(n) Kontamination(en) der zu untersuchenden Zubereitung widerspiegeln."
Um dieser Anforderung gerecht zu werden, bieten wir ein erweitertes Sortiment an Positivkontrollen an:
- Reflektieren mehrere Arten von Verunreinigungen, die üblicherweise in pharmazeutischen Produktionsprozessen vorkommen (Gram-negative und Gram-positive Bakterien, Viren und Mykoplasmen).
- Targeting auf mehrere monozytäre Toll-like-Rezeptoren (TLR)

- Nachweis eines breiten Spektrums von Pyrogenen: Wie der Kaninchen-Pyrogentest (RPT) weist der MAT sowohl Endotoxine als auch NEPs nach.
- Erweiterte Palette von Produkten, die getestet werden können: Die am häufigsten angewandten Methoden, RPT, Bacterial Endotoxin Test (BET) und LAL, sind in den Produkttypen, für die sie verwendet werden können, begrenzt. Der MAT bietet eine größere Flexibilität hinsichtlich seiner Anwendungen.
- Ein in vitro Assay, der die menschliche Immunreaktion nachahmt: Für ein robustes Vorhersagemodell, das den Tierverbrauch reduziert.
- Konformität mit internationalen Vorschriften und Richtlinien: In Übereinstimmung mit ethischen Trends der Industrie und der Aufsichtsbehörden zur Verringerung der Verwendung von Tierversuchen.
- Kryokonserviertes Blut von 8 Spendern: Um der menschlichen Immunreaktion auf Pyrogene so nahe wie möglich zu kommen.
Optimieren oder vereinfachen Sie Ihre Pyrogentestmethode für eine einfache Validierung und kosteneffiziente Tests mit unseren Dienstleistungsangeboten:
- Anwendungsdienstleistungen
- Validierungsdienstleistungen
- Schulungsdienstleistungen
Mangelnde Ressourcen für die MAT-Implementierung und -Validierung. Wir machen das für Sie!
Machbarkeitsstudie, Methodenentwicklung, Validierung & Schulungsdienstleistungen zur Unterstützung Ihrer Pyrogentest-Implementierung, besprechen Sie mit unseren Pyrogen Testing Experts.
Verwandte Ressourcen
- Brochure: PyroMAT® and PyroDetect
Used to detect a broad range of pyrogens in parenteral products such as pharmaceuticals, biopharmaceuticals or medical devices, the MAT gives an in vitro alternative to conventional animal testing in accordance with regulatory guidelines.
- Datasheet: Non-endotoxin Pyrogen Positive Controls
Meet regulatory requirements for Monocyte Activation Test (MAT) with our non-endotoxin pyrogen controls designed for the PyroMAT® system
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?