Hodowla monowarstw pochodzących z organoidów jelita cienkiego przy użyciu wkładek Millicell®
Co to jest hodowla komórkowa 2.5D?
W hodowli komórkowej 2.5D badacze hodują dwuwymiarową monowarstwę komórek na fizycznych rusztowaniach, takich jak wkłady do hodowli komórkowych, z powłoką biologiczną lub syntetycznym polimerem. Zachęca to do wzrostu zróżnicowanych struktur, które są najczęściej kojarzone z kulturami 3D i zwiększa przyczepność i różnicowanie.
Chociaż kultury organoidalne 3D oferują kilka zalet w porównaniu z dwuwymiarowymi modelami jednowarstwowymi komórek, w tym lepsze odzwierciedlenie cech fizjologicznych i złożoności biologicznej, kultury 3D nie są przystosowane do zastosowań takich jak przezbłonkowego oporu elektrycznego (TEER) w celu oceny integralności bariery, napływu/odpływu leków, migracji i inwazji oraz testów gojenia się ran. Aby odpowiedzieć na te ważne pytania, organoidy są dysocjowane na pojedyncze komórki i hodowane na błonach jako monowarstwy w kulturach 2,5D.
Jelito cienkie jest miejscem wchłaniania leków i jest bardzo istotnym modelem toksyczności leków, przepuszczalności i napływu/odpływu. W hodowli 3D in vitro organoidy jelitowe tworzą struktury przypominające pęcherzyki z wewnętrzną (wierzchołkową) stroną struktury odpowiadającą światłu (strona wchłaniania) i zewnętrzną (strona podstawno-boczna) odpowiadającą obszarowi skierowanemu do naczyń krwionośnych. Taka konfiguracja sprawia, że leczenie związkami, które są wchłaniane po stronie wierzchołkowej, stanowi wyzwanie. Jeśli jednak ta sama linia organoidów jest hodowana na wkładce transmembranowej, powstaje spolaryzowana monowarstwa ze stroną wierzchołkową na górze i stroną podstawno-boczną na dole wkładki, co pozwala na ocenę przepuszczalności leku i integralności bariery (rysunek 1).
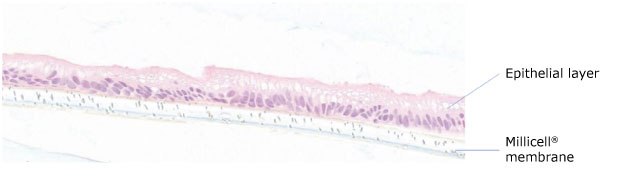
Rysunek 1.Przekrój ludzkich organoidów dwunastnicy Duo-87 (PDO) hodowanych na membranie Millicell® przez 8 dni, pokazujący spolaryzowaną monowarstwę nabłonkową. Warstwa nabłonkowa znajduje się w górnej części przekroju w kolorze różowym, a membrana Millicell® znajduje się w dolnej części przekroju w kolorze białym.
Obecnie standardowym modelem dla testów bariery jelitowej jest linia komórkowa raka jelita grubego, Caco2. Jednak długi czas wzrostu (około 20 dni) i charakterystyka okrężnicy są niekorzystne dla dokładnej oceny wpływu leku na główny narząd wchłaniania, jelito cienkie.
Używając systemu 2.5D, naukowcy mogą monitorować przez dłuższy czas i obserwować skutki uboczne, takie jak skumulowana toksyczność leku, które mogą zostać pominięte w krótkoterminowych testach. Na przykład lek prostacyklina ma bardzo krótki okres półtrwania w roztworze, co utrudnia ustalenie skutków długoterminowych. Tutaj demonstrujemy hodowlę 2.5D z wykorzystaniem jelita cienkiego, organoidów pochodzących z 3dGRO® duodenum organoids (Duo-87) w celu monitorowania długoterminowych skutków ubocznych i toksyczności leków.
Hodowla monowarstw jelitowych na wkładkach Millicell®. Inserts
Materiały i metody
- 3dGRO® Duodenum Organoids Duo-87 (SCC322)
- 3dGRO® L-WRN Conditioned Media Supplement (SCM105)
- TrypLE Express
- Matrigel®
- Millicell® 24-dołkowa wkładka wisząca, rozmiar porów 1 µM (PTRP24H8)
- Płytki wielodołkowe
- Millicell® ERS 3.0 Digital Voltohmmeter (MERS03000)
Dysocjacja pojedynczych komórek modelu jelita cienkiego Duo-87 pochodzącego od pacjenta (PDO) w 5. dniu hodowli w pełnym podłożu L-WRN przy użyciu odczynnika do dysocjacji komórek TrpLE Express. Po dysocjacji, hoduj komórki Duo-87 na 2% GFR Matrigel® pokrytym Millicell® 24-dołkowymi wiszącymi wkładkami do hodowli komórkowej w płytkach wielodołkowych (schemat pracy 1). Zmierzyć przezbłonową oporność elektryczną (TEER) za pomocą woltomierza Millicell® ERS 3.0.
Przepływ pracy
Rozwiń, aby uzyskać więcej szczegółów.
Krok 2
~10 x 10 µL kopułek daje 100 tys. komórek
Krok 3
200k/wkład wymaga ~20 x 10 µL kopułek
Krok 4
Potrzebujemy ~240 x 10 µL kopułek na 24 wkładki
Przebieg pracy 1. Przybliżona liczba organoidów SCC322 Duo-87 i pojedynczych komórek wymagana do posiania 24-dołkowej płytki wstawkowej.
Duodenum Organoids Drug Toxicity Results
Organoidalne monowarstwy hodowane w pożywce proliferacyjnej składają się głównie z komórek nabłonkowych pochodzących z populacji komórek macierzystych. Wiele wyspecjalizowanych komórek jelita cienkiego, takich jak antybakteryjne komórki Panetha, produkujące mucynę komórki Gobleta i komórki enteroendokrynne, które wydzielają różne hormony, są niedostatecznie reprezentowane.
Hodowla monowarstw jelitowych w pożywce różnicującej sprzyja tworzeniu tych wyspecjalizowanych komórek, zapewniając bardziej fizjologiczny model jelita. Różnicę we właściwościach między monowarstwami utrzymywanymi w pożywce proliferacyjnej lub różnicującej można zaobserwować poprzez wartości TEER w czasie (rysunek 2).
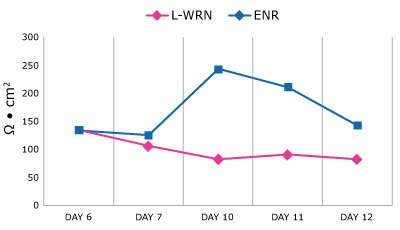
Rysunek 2.Wartości TEER dla organoidów Duo-87 hodowanych na 96-dołkowych wkładkach Millicell® (PSRP004). Wartości TEER wzrastają dla studzienek przełączonych z pożywki proliferacyjnej (L-WRN, różowy) na pożywkę różnicującą (ENR, niebieski). Wartości TEER organoidów Duo-87 hodowanych na pożywce L-WRN nie osiągają wartości szczytowych w czasie, podczas gdy wartości TEER organoidów Duo-87 hodowanych na pożywce ENR osiągają wartość szczytową w dniu 10 i stopniowo spadają do wartości początkowej w dniu 12.
Pojedyncze komórki z dwunastnicy PDO zostały wysiane do 24-dołkowych wkładek Millicell® i osiągnęły konfluentne monowarstwy do 10 dnia. Wartości TEER mierzono codziennie, aby uzyskać przebieg czasowy do oceny stanu monowarstwy do momentu jej naturalnej dysocjacji po 25-28 dniach hodowli. Po 11 dniach wartości TEER spadły dla organoidów Duo-87 poddanych działaniu prostacykliny. Sugeruje to skumulowany wpływ leku na integralność błony (rysunek 3).
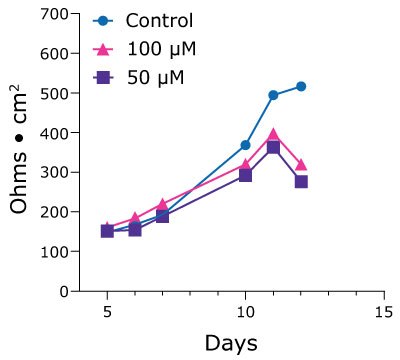
Rysunek 3.Wartości TEER dla organoidów Duo-87 na 24-dołkowych wkładkach Millicell® traktowanych roztworem kontrolnym (niebieskie kółka), 100 µM prostacykliny (różowe trójkąty) lub 50 µM prostacykliny (fioletowe kwadraty). Wartości TEER dla organoidów Duo-87 poddanych działaniu roztworu kontrolnego stopniowo wzrastają w miarę upływu czasu. Wartości TEER dla organoidów Duo-87 traktowanych 100 µM i 50 µM prostacykliny rosną do 11 dnia, po czym linie gwałtownie spadają.
Kultura komórkowa 2.5D może również pomóc naukowcom badającym toksyczność leków ujawnić bardziej subtelne efekty, które są maskowane przez testy żywotności komórek. Słabo tolerowany przez jelita lek chemioterapeutyczny afatynib jest bardzo silny, ale powoduje 96% częstość występowania biegunkowych skutków ubocznych. Traktowanie monowarstw dwunastnicy 0,5 µM afatynibem in vitro powoduje śmierć komórek i rozpad monowarstwy. Jednak niższe stężenia wykazują zależne od dawki opóźnienie we wzroście wartości TEER w czasie (rysunek 4).
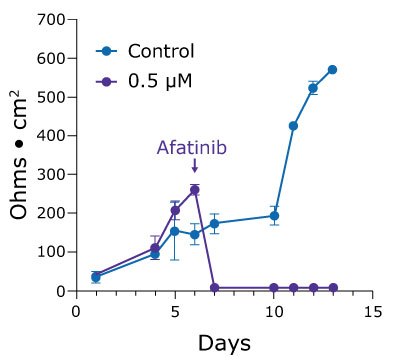
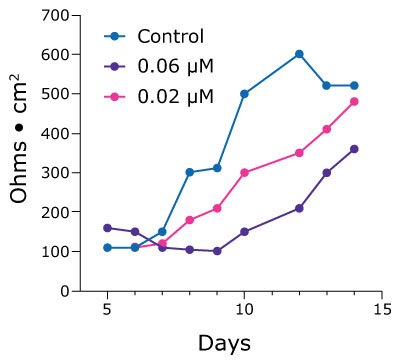
Rysunek 4. Wartości TEER dla organoidów Duo-87 na 24-dołkowych wkładkach Millicell® leczonych afatynibem. A.) Wartości TEER dla organoidów Duo-87 poddanych działaniu roztworu kontrolnego (niebieski) lub 0,5 µM afatynibu (fioletowy). Przy tym stężeniu wartości TEER stopniowo rosną, a następnie gwałtownie spadają, wskazując na śmierć komórki. B). Wartości TEER Duo-87 po traktowaniu roztworem kontrolnym (niebieski), 0,06 µM afatynibem (fioletowy) lub 0,02 µM afatynibem (różowy). Zwiększanie dawek afatynibu poniżej wartości IC50 wynoszącej 0,5 µM powoduje zależne od dawki opóźnienie wzrostu wartości TEER.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?