Wprowadzenie do przeciwciał: Interakcja przeciwciało-antygen
Teraz, gdy już wiesz, czym są antygen i przeciwciało, rozważmy interakcję między nimi. Siła interakcji między przeciwciałem a antygenem w pojedynczych miejscach antygenowych może być opisana przez powinowactwo przeciwciała do antygenu. W każdym miejscu antygenowym zmienny region "ramienia" przeciwciała oddziałuje poprzez słabe siły niekowalencyjne z antygenem w wielu miejscach. Im większa interakcja, tym silniejsze powinowactwo. Płynność jest prawdopodobnie bardziej informacyjną miarą ogólnej stabilności lub siły kompleksu przeciwciało-antygen. Jest ona kontrolowana przez trzy główne czynniki: powinowactwo epitopu przeciwciała, wartościowość zarówno antygenu, jak i przeciwciała oraz układ strukturalny oddziałujących części. Ostatecznie czynniki te definiują swoistość przeciwciała, czyli prawdopodobieństwo, że dane przeciwciało wiąże się z konkretnym epitopem antygenu.
Reaktywność krzyżowa odnosi się do przeciwciała lub populacji przeciwciał wiążących się z epitopami na innych antygenach. Może to być spowodowane niską awidnością lub swoistością przeciwciała lub wieloma różnymi antygenami o identycznych lub bardzo podobnych epitopach. Reaktywność krzyżowa jest czasami pożądana, gdy chce się uzyskać ogólne wiązanie z pokrewną grupą antygenów lub podczas próby znakowania międzygatunkowego, gdy sekwencja epitopu antygenu nie jest wysoce konserwowana w trakcie ewolucji. Reaktywność krzyżowa może skutkować przeszacowaniem lub niedoszacowaniem stężenia antygenu i jest problematyczna w testach immunologicznych. Techniki immunochemiczne wykorzystują ekstremalną specyficzność, na poziomie molekularnym, każdej immunoglobuliny dla jej antygenu, nawet w obecności wysokich poziomów cząsteczek zanieczyszczających. Wielowartościowość większości antygenów i przeciwciał umożliwia ich interakcję w celu utworzenia osadu. Przykładami zastosowań eksperymentalnych wykorzystujących przeciwciała są Western blot, immunohistochemia i immunocytochemia, test immunoenzymatyczny (ELISA), immunoprecypitacja i cytometria przepływowa. Każdy z nich został omówiony bardziej szczegółowo w dalszej części niniejszego przewodnika.
Kinetyka interakcji antygen-przeciwciało
Natura wiązań antygen-przeciwciało
Czynniki wpływające na reakcje antygen-przeciwciało
Kinetyka interakcji antygen-przeciwciało
Specyficzna asocjacja antygenów i przeciwciał zależy od wiązań wodorowych, oddziaływań hydrofobowych, sił elektrostatycznych i sił Van der Waalsa. Mają one słaby, niekowalencyjny charakter, jednak niektóre z powiązań między antygenem a przeciwciałem mogą być dość silne. Podobnie jak przeciwciała, antygeny mogą być wielowartościowe, albo poprzez wiele kopii tego samego epitopu, albo poprzez obecność wielu epitopów, które są rozpoznawane przez wiele przeciwciał. Interakcje obejmujące wielowartościowość mogą wytwarzać bardziej stabilne kompleksy; jednak wielowartościowość może również powodować trudności steryczne, zmniejszając w ten sposób możliwość wiązania. Wiązanie przeciwciał z antygenem jest odwracalne i przebiega zgodnie z podstawowymi zasadami termodynamicznymi każdej odwracalnej interakcji dwucząsteczkowej:
.
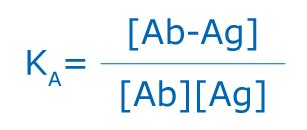
gdzie KA jest stałą powinowactwa, [Ab-Ag] jest stężeniem molowym kompleksu przeciwciało-antygen, a [Ab] i [Ag] są stężeniami molowymi niezajętych miejsc wiązania odpowiednio przeciwciała (Ab) lub antygenu (Ag).
Czas potrzebny do osiągnięcia równowagi zależy od szybkości dyfuzji i powinowactwa przeciwciała do antygenu i może się znacznie różnić. Stała powinowactwa dla wiązania przeciwciało-antygen może obejmować szeroki zakres, rozciągający się od poniżej 105/mol do powyżej 1012/mol. Na stałą powinowactwa może wpływać temperatura, pH i rozpuszczalnik. Stałe powinowactwa można określić dla przeciwciał monoklonalnych, ale nie dla przeciwciał poliklonalnych, ponieważ między przeciwciałami poliklonalnymi a ich antygenami dochodzi do tworzenia wielu wiązań. Ilościowe pomiary powinowactwa przeciwciał do antygenu można wykonać za pomocą dializy równowagowej. Powtarzane dializy równowagowe ze stałym stężeniem przeciwciała, ale zmieniającym się stężeniem liganda, są wykorzystywane do generowania wykresów Scatcharda, które dostarczają informacji o wartości powinowactwa i możliwej reaktywności krzyżowej.
Przy projektowaniu procedur eksperymentalnych ważne jest rozróżnienie między przeciwciałami monoklonalnymi i poliklonalnymi, ponieważ różnice te są podstawą zarówno zalet, jak i ograniczeń ich stosowania.
Natura wiązań antygen-przeciwciało
Miejsce łączenia przeciwciała znajduje się w części F(ab) cząsteczki przeciwciała i jest złożone z hiperzmiennych regionów łańcuchów ciężkich i lekkich. Wiązanie między tym miejscem a antygenem odbywa się z następującymi cechami i procesami:
- Wiązania, które utrzymują antygen w miejscu łączenia dowolnego przeciwciała, są niekowalencyjne, a zatem mają charakter odwracalny.
- Wiązania te mogą być wiązaniami wodorowymi, wiązaniami elektrostatycznymi lub siłami Van der Waalsa.
- Zwykle obserwuje się wiele formacji wiązań, zapewniając stosunkowo ścisłe wiązanie między przeciwciałem a antygenem.
- Specyficzne wiązanie między determinantą antygenową na komórce (znaną jako epitop) a miejscem łączenia antygenu (paratopem) na przeciwciałach obejmuje bardzo małe części cząsteczek, zwykle zawierające tylko kilka aminokwasów.
- Miejsca te są krytyczne w reakcjach antygen-przeciwciało, ponieważ specyficzne wiązanie musi przezwyciężyć odpychanie między dwiema cząsteczkami.
- Kiedy epitop wchodzi w kontakt z paratopem, są one najpierw przyciągane do siebie przez siły jonowe i hydrofobowe.
- Siły te pomagają im przezwyciężyć ich energie hydratacji i pozwalają na wydalenie cząsteczek wody, gdy epitop i paratop zbliżają się do siebie.
- Przyciąganie to staje się jeszcze silniejsze, gdy siły Van der Waalsa są wykorzystywane później, aby jeszcze bardziej zbliżyć epitop i paratop.
Czynniki wpływające na reakcje antygen-przeciwciało
Na reakcję antygen-przeciwciało może wpływać kilka czynników. Niektóre z bardziej powszechnych czynników to:
Temperatura
Optymalna temperatura dla reakcji antygen-przeciwciało będzie zależeć od chemicznej natury epitopu, paratopu i rodzaju wiązań zaangażowanych w ich interakcję. Na przykład tworzenie wiązań wodorowych jest egzotermiczne. Wiązania te są bardziej stabilne w niższej temperaturze i mogą być ważniejsze w przypadku antygenów węglowodanowych.
pH
Wpływ pH na stałą równowagi kompleksu antygen-przeciwciało leży w zakresie pH od 6,5 do 8,4. Poniżej pH 6,5 i powyżej pH 8,4 reakcja antygen-przeciwciało jest silnie hamowana. Przy pH 5,0 lub 9,5 stała równowagi jest 100-krotnie niższa niż przy pH 6,5-7,0. W ekstremalnych warunkach pH przeciwciała mogą ulegać zmianom konformacyjnym, które mogą zniszczyć komplementarność z antygenem.
Siła jonowa
Wpływ siły jonowej na reakcję antygen-przeciwciało jest szczególnie ważny w serologii grup krwi. W tym przypadku na reakcję znacząco wpływają jony sodu i chlorku. Na przykład w normalnym roztworze soli Na+ i Cl- skupiają się wokół kompleksu i częściowo neutralizują ładunki, potencjalnie zakłócając wiązanie przeciwciała z antygenem. Może to być problematyczne w przypadku stosowania przeciwciał o niskim powinowactwie. Powszechnie wiadomo, że po wystawieniu na działanie bardzo niskich sił jonowych, γ-globuliny agregują i tworzą odwracalne kompleksy z lipoproteinami czerwonych krwinek, prowadząc do ich sedymentacji.
Kontynuuj naukę o przeciwciałach z naszym artykułem o generowaniu przeciwciał.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?