Virusbasierte Impfstoffherstellung
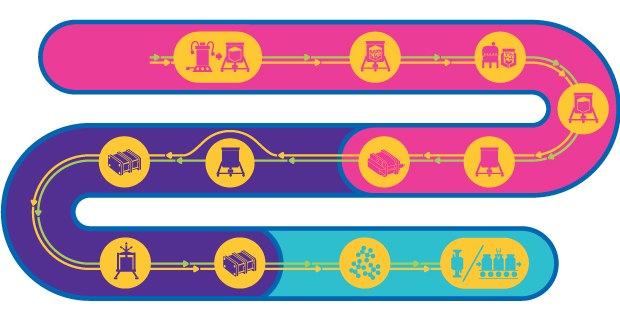
Prozesslinie für inaktivierte & attenuierte Lebendviren
Virusbasierte Impfstoffe bestehen entweder aus attenuierten oder inaktivierten Viren. Diese Impfstoffe können alle Phasen des Immunsystems aktivieren und bieten eine schnelle und dauerhafte Langzeitimmunität, indem sie die Bildung neutralisierender Antikörper gegen den Zielerreger anregen.
Das Verfahren zur Herstellung von Impfstoffen auf Basis attenuierter Viren ist komplex, besteht aus mehreren Schritten und muss das infektiöse Potenzial des attenuierten Virus erhalten. Für die Herstellung gibt es zwar einen generellen Workflow, jedoch keinen Template-basierten Ansatz. Stattdessen muss jedes Verfahren auf Form, Größe, Art, das physikalisch-chemische Verhalten, Stabilität und Wirtsspezifität des Virus zugeschnitten sein.
Ausgewählte Kategorien
Prozesschemikalien sind Schlüsselkomponenten für biopharmazeutische ...
Unsere vorgefertigten und kundenspezifisch anpassbaren Zellkulturmedien für das Bioprocessing steigern die Produktivität in den Upstream-Prozessen der mAb-, Impfstoff-, Gen- und Zelltherapie-Herstellung.
Eine auf Transfektion basierende Lösung für die Produktion viraler Vektoren unter Verwendung einer Suspensionszelllinie, eines chemisch definierten Mediums und eines Verfahrens mit bewährter Leistung im großen Maßstab.
Durch unsere gebrauchsfertigen, serienmäßig produzierten Zellliniensysteme werden Zeitaufwand, Kosten und das Risiko bei der Entwicklung neuer Zelllinien für die Produktion erheblich gesenkt. Ganz gleich, ob Sie Antikörper, rekombinante Proteine, Impfstoffe oder virale Vektoren für Gentherapien herstellen, unsere Zelllinienplattformen können Ihren Fortschritt in Upstream-Bereichen beschleunigen.
Workflow


Downstream Processing viraler Vektoren
Durch effiziente Virusaufreinigungsverfahren können die Ausbeute verbessert, die Zeit bis zum Patienten verkürzt und die Herstellungskosten gesenkt werden

Formulierung und Endabfüllung viraler Vektoren
Die Formulierung einer kommerziell nutzbaren Gentherapie erfordert ein hohes Maß an Erfahrung in der Anwendung gepaart mit regulatorischem Know-how

Charakterisierung viraler Vektoren und Biosicherheitsprüfungen
Kritische Biosicherheitsprüfungen und die Charakterisierung von Virusvektorprodukten können dabei helfen, Sicherheitsbedenken zu verringern und das Produktverständnis zu verbessern

Auftragsentwicklung und -herstellung viraler Vektoren
CDMO-Partnerschaften spielen eine entscheidende Rolle beim Voranbringen klinischer Pipelines und bei der erfolgreichen Kommerzialisierung
Auftauen und Expandieren von Zellen und Saatviren
Eingefrorene Zellen aus einer Arbeits- oder Masterzellbank werden aufgetaut und expandiert, um ihre Anzahl in Vorbereitung auf nachfolgende Prozessschritte zu erhöhen.
Herstellung der Medien und des Inokulums
Zellkulturmedien werden mit den geeigneten Nährstoffen, Supplementen und pH-Milieus für das Zellwachstum und die Virusherstellung optimiert.
Zellwachstum und Virusherstellung
Zellen werden in einem Bioreaktor oder einer anderen kontrollierten Umgebung unter spezifischen Bedingungen gezüchtet, um die Virusherstellung zu maximieren.
Zelllyse
Bei der Herstellung von AVV werden Wirtszellen chemisch oder mechanisch lysiert, sodass die Viren in die Medien gegeben werden können.
DNA-Abbau
Unerwünschte ganze Zellen und Plasmid-DNA werden mithilfe eines Nukleaseenzyms verdaut.
Besuchen Sie unsere Dokumentensuche, wo Sie Datenblätter, Zertifikate und technische Dokumentation finden.
Zugehörige Artikel
- Scaling up viral vector production using adherent cell culture systems is challenging. Learn how suspension cell culture systems benefit large-scale bioprocessing.
- A step-by-step overview of suspension-based, transient transfection bioreactor process development and scaleup of lentivirus production.
- To address scalability challenges of AAV manufacturing, we developed an HEK293 suspension cell line that can be used across many serotypes. Get the data in this article.
- Alle anzeigen (4)
Zugehörige Dokumente
- Product Guide: Upstream Chemicals for Bioprocessing
We offer a broad portfolio of raw materials and chemical components suitable for cell culture media formulations and upstream applications used in biopharmaceutical production.
- White Paper: Application of the Sf-Rhabdovirus-Negative (Sf-RVN®) Platform for AAV Production
The Sf-RVN® Platform is a two-part system comprising a proven Sf-9 cell line devoid of Sf-rhabdovirus (the Sf-RVN® cell line) and a chemically defined medium engineered for the cell line, the EX-CELL® CD Insect Cell Medium.
- Brochure: Gene Therapy Capabilities for AAV and Lentivirus Production
Our products and services for AAV, Lentivirus and other viral vectors provide solutions to your most challenging pain points around process development, speed, manufacturing and regulatory guidelines.
- Transcript: Exploring the Potential of Insect Cell Lines for Efficient AAV Production
Interview transcript with GTRI and their findings of using the Sf-RVN® Platform.
Zugehörige Videos
Benzonase® Nuklease baut DNA und RNA effizient in Fragmente von weniger als 5 Basenpaaren ab.
Von der Skalierung über die Bewältigung regulatorischer Hürden bis hin zur reibungslosen Produktion.
Skalieren Sie Ihre Gentherapieproduktion erfolgreich mit einem frühzeitig implementierten Plattformprozess.
Zur Verbesserung des Sicherheitsprofils Ihrer Gentherapien und Impfstoffe
Webinare zu diesem Thema
Mit der Herstellung viraler Vektoren in Form von AAV für die Gentherapie gehen ganz spezielle Herausforderungen im Upstream-Prozess einher. Erfahren Sie, wie Sie mithilfe unserer HEK-Plattform diese Hürden meistern können.
Wie wir weiterhelfen können
Sollten Sie Fragen haben, reichen Sie bitte eine Anfrage beim Kundensupport
ein oder sprechen Sie mit unserem Kundenservice:
E-Mail custserv@sial.com
oder telefonisch unter +1 (800) 244-1173
Weitere Unterstützung
- Rechner & Apps
Web-Toolbox - wissenschaftliche Forschungstools und Informationsquellen für die Bereiche analytische Chemie, Life Science, chemische Synthese und Materialwissenschaft.
- Customer Support Request
Customer support including help with orders, products, accounts, and website technical issues.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
Zugehörige Fachartikel
- Adjuvant selection is dependent on vaccine formulation and individual application. Effectiveness and safety are of primary importance in adjuvant selection, yet a number of other characteristics must be considered
- Alle anzeigen (0)
Mehr Artikel und Protokolle finden
Optimierung der Upstream-Processing-Produktivität und Klärfiltration durch zuverlässige Skalierung
Die für die Herstellung von Impfstoffen auf Virusbasis entwickelten Upstream-Kulturverfahren müssen optimiert werden, um den Produktivitätsanforderungen gerecht zu werden. Diese Optimierung schließt den Klärfiltrationsschritt ein, der für die Entfernung von Zellen und Zelltrümmern und zur Sicherstellung einer robusten Virusernte unerlässlich ist. Der Upstream-Prozess ist jedoch nur dann erfolgreich, wenn er zuverlässig skaliert werden kann, um damit der antizipierten Marktnachfrage gerecht zu werden.
Erreichen von Ausbeute- und Effizienzzielen durch robuste Abscheidung von Verunreinigungen
Nukleinsäuren aus lysierten Zellen sind eine häufig auftretende Kontaminante in virusbasierten Impfstoffprozessen. In gesetzlichen Vorschriften ist festgelegt, dass der Gehalt an verschleppter Wirtszellnukleinsäure unter 10 ng/Dosis eines Impfstoffs auf Basis attenuierter Viren liegen muss. Die Benzonase® Endonuklease-Behandlung mit anschließender Tangentialflussfiltration ist eine robuste und leistungsstarke Kombination zum Abbau und zur anschließenden Entfernung von Rest-Nukleinsäurekomponenten.
Maximierung der Downstream-Rückgewinnung
Die Behandlung mit Benzonase® Endonuklease reicht aus, um den gewünschten Reinheitsgrad für die meisten virusbasierten Impfstoffe während der Konzentration und Diafiltration zu erreichen. Die Chromatographie ist jedoch erforderlich, um die Reinheitsziele für virusbasierte Impfstoffe der nächsten Generation, wie das Japanische Enzephalitis-Virus (JEV) und das Dengue-Virus (DENV), zu erreichen. Da jeder Herstellungsprozess auf die Eigenschaften des Virus zugeschnitten sein muss, ist eine Reihe von Optionen für die Downstream-Aufreinigung unerlässlich, um die gewünschte Reinheit zu erzielen und gleichzeitig eine optimale Rückgewinnung zu gewährleisten.
Sicherstellen der Patientensicherheit
Auch wenn virusbasierte Impfstoffe mit attenuierten Viren hergestellt werden, bleibt die Gewährleistung der Patientensicherheit ein wichtiges Anliegen. Das endgültige Volumen des Virusimpfstoffs ist mit dem von Wasser vergleichbar. So kann der Impfstoff vor der Endformulierung und Abfüllung & Fertigstellung durch eine 0,22-µm-Sterilfiltration sterilisiert werden.
Nuklease-Behandlung & Klärfiltration
Garantierte robuste Skalierbarkeit:
- Nuklease-Behandlung mit Benzonase® Für die Produktion biopharmazeutischer Produkte geeignet EMPROVE® Bio
- Benzonase® Nachweis mit dem Benzonase® Elisa Kit II zum Nachweis von Benzonase® Endonuklease-Resten im Prozess
- Primär-/Sekundär-Klärfiltration mit Millistak+® HC POD-Tiefenfiltern
- Primär-Klärfiltration mit Clarisolve® Tiefenfiltern
- Sekundär-Klärfiltration mit Polysep II-Filterelementen
- Sekundär-Klärfiltration mit Milligard® PES-Filtern
Flüssige Zellkulturmedien & Puffer für das Bioprocessing
Wir verfügen über branchenführende Kapazitäten für sterilfiltrierte Flüssigkeiten höchster Qualität und liefern gebrauchsfertige Zellkulturmedien, Puffer, CIP- und SIP-Produkte aus GMP-Anlagen weltweit für die Optimierung Ihrer Biopharmaproduktion.

Downstream – Tangentialflussfiltration
Erreichen Sie Ihre Ziele in Bezug auf Ausbeute, Effizienz und Virusrückgewinnung und stellen Sie gleichzeitig eine zuverlässige Abscheidung von Verunreinigungen sicher.
- Ultrafiltration / Diafiltration mit Pellicon® 2 Kassetten
- Ultrafiltration / Diafiltration mit Pellicon® 3 Kassetten
- Ultrafiltration / Diafiltration Pellicon® Kapsulen mit Ultracel® Membran
- Mobius® TFF 80 System, Mobius® FlexReady-Lösung für die TFF, Cogent®-Laborsysteme und Cogent®-System zur Tangentialflussfiltration im Prozessmaßstab
Downstream – Chromatographie
- Membranchromatographie mit Eshmuno® Q Harz
- Membranchromatographie mit Natrix® Q Recon Mini Chromatographiemembranen
- Membranchromatographie mit Natrix® Q Pilot Chromatographiemembran
- Capture- und/oder Polishing-Chromatographie mit Fractogel® EMD DEAE Chromatographieharzen
- Capture- und/oder Polishing-Chromatographie mit Fractogel® EMD DMAE Chromatographieharzen
- Mobius® FlexReady-Lösung für die Chromatographie
Virusinaktivierung

Finale Sterilfiltration & Abfüllung
Bedenken hinsichtlich der Kreuzkontamination von Produkten ausräumen, Anforderungen an Abfüllung & Fertigstellung optimieren und geltende gesetzliche Anforderungen einhalten.
- Finale Sterilfiltration & Abfüllung
- Strategien für die Sterilfiltration
- Sterile Probenahme mit NovaSeptum® GO Sterilprobenahmelösungen
- Abfüllung & Fertigstellung mit Mobius® Einweglösungen für die Abfüllung und Fertigstellung
- Millipak® Filter für die Endabfüllung
- Mobius® 2D- und 3D-Baugruppen und Lagersysteme
Weitere Informationsquellen
- Application Guide: Biopharmaceutical
A search tool to help you overcome your manufacturing challenges.
- Brochure: Vaccine Bioprocessing Handbook
In this handbook, we explain the vaccine production processes and process improvements for all types of vaccine development platforms.
- Mini-Handbook: Cell-Based Vaccine Bioprocessing
Live attenuated viral vaccines can be created using a complex, multi-step cell-based manufacturing process. It is not a templated process. The manufacturing process for each viral vaccine is different.
- e-Book: Enabling Capabilities & Solutions for all Vaccine Platforms
From process development to full-scale GMP-manufacturing, our global vaccine capabilities can help you achieve these goals for all your modalities/platforms including virus-based, subunit, VLP, viral vector, pDNA and mRNA vaccines.
- White Paper: Filtration Strategies for Optimal Development and Purification of a Foot and Mouth Disease Virus
We collaborated with MEVAC to optimize upstream and downstream processes for FMD vaccine manufacturing to establish a scalable, cost-efficient and GMP compliant process. This white paper focuses on the integration of new filtration strategies in both upstream and downstream processes.
- White Paper: Downstream Process Intensification for Virus Purification Using Membrane Chromatography
This white paper provides an overview of the challenges presented by current approaches to virus production and the opportunities to develop a platform approach that can work across different viral modalities and accelerate process development.
- Application Note: Effect of Benzonase® Endonuclease Addition to Purification of Sabin Polio Virus Type 3
This application note summarizes the benefits of incorporating Benzonase® endonuclease in a polio virus type 3 production process.
- Article: Filter-Based Clarification of Viral Vaccines and Vectors
In this article, a comprehensive overview is provided on different filtration technologies and their application in viral vaccine clarification, outlining challenges and present current best practices.
Zugehörige Produkte
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?










