바이러스 기반 백신 제조
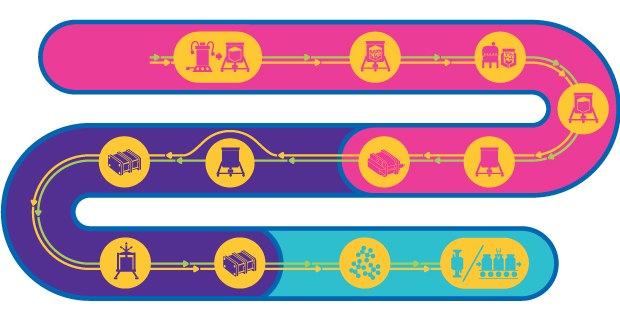
불활성 및 약독화 생 바이러스 모두를 위한 트레인
약독화 및 불활성화 바이러스로 구성된 바이러스 기반 백신. 이 백신은 면역 체계의 모든 상을 활성화할 수 있으며, 표적 병원체에 맞서 중화 항체를 끌어냄으로써 빠르고 지속적인 장기 면역을 제공합니다.
약독화 바이러스 기반 백신 제조 공정은 복잡하며 여러 단계로 구성되어 약독화 바이러스로 인한 전염 위험이 유지됩니다. 생산에 대한 일반적 워크플로가 존재하지만 제조를 위한 템플릿화된 접근법은 존재하지 않습니다. 대신 각 공정은 바이러스 모양, 크기, 특성, 물리 화학 작용, 안정성 및 숙주의 특이성에 기반한 맞춤형이어야 합니다.
주요 카테고리
당사의 기성품 및 맞춤형 바이오프로세싱 세포 배양 배지(CCM) 제품은 업스트림 mAb, 백신, 유전자/세포 치료 공정의 생산성을 향상시킵니다.
워크플로


바이러스 벡터 다운스트림 공정
효율적인 바이러스 정제 공정으로 수율을 개선하고 환자에 도달하는 시간을 줄이고 제조 비용을 절감할 수 있습니다.

바이러스 벡터 제형 및 최종 주입
상업적으로 성장 가능한 유전자 치료제를 고안하기 위해서는 높은 수준의 애플리케이션 및 규제에 대한 전문성이 필요합니다.

바이러스 벡터 특성화 및 생물안전성 검사
중요한 생물안전성 검사와 바이러스 벡터 제품의 특성화는 안전성 문제를 줄이고 제품 이해를 높이는 데 도움이 될 수 있습니다.

바이러스 벡터 수탁 개발 및 제조
CDMO 파트너십은 임상 파이프라인을 개발하고 성공적인 상업화를 달성하는 데 중요한 역할을 합니다.
세포 및 시드의 해동 및 증식
작업 세포 은행 또는 마스터 세포 은행의 냉동 세포는 해동되고 확장되어 후속 처리 단계에 대비하여 그 수를 늘립니다.
배지 및 접종물 준비
세포 배양 배지는 세포 성장 및 바이러스 생산을 위해 적절한 영양소, 보충제, pH로 최적화됩니다.
세포 성장 및 바이러스 생산
세포는 바이러스 생산을 극대화하기 위해 특정 조건 하에서 바이오리액터 또는 기타 제어되는 환경에서 성장합니다.
세포 용해
AAV 생산에서, 숙주 세포는 화학적 또는 기계적 방법에 의해 용해되어 바이러스가 배지 안으로 방출될 수 있게 합니다.
DNA 절단
원치 않는 전체 세포 및 플라스미드 DNA는 핵산분해효소를 이용하여 절단됩니다.
관련 자료
- Scaling up viral vector production using adherent cell culture systems is challenging. Learn how suspension cell culture systems benefit large-scale bioprocessing.
- A step-by-step overview of suspension-based, transient transfection bioreactor process development and scaleup of lentivirus production.
- To address scalability challenges of AAV manufacturing, we developed an HEK293 suspension cell line that can be used across many serotypes. Get the data in this article.
- 모두 보기 (4)
관련 자료
- Product Guide: Upstream Chemicals for Bioprocessing
We offer a broad portfolio of raw materials and chemical components suitable for cell culture media formulations and upstream applications used in biopharmaceutical production.
- White Paper: Application of the Sf-Rhabdovirus-Negative (Sf-RVN®) Platform for AAV Production
The Sf-RVN® Platform is a two-part system comprising a proven Sf-9 cell line devoid of Sf-rhabdovirus (the Sf-RVN® cell line) and a chemically defined medium engineered for the cell line, the EX-CELL® CD Insect Cell Medium.
- Brochure: Gene Therapy Capabilities for AAV and Lentivirus Production
Our products and services for AAV, Lentivirus and other viral vectors provide solutions to your most challenging pain points around process development, speed, manufacturing and regulatory guidelines.
- Transcript: Exploring the Potential of Insect Cell Lines for Efficient AAV Production
Interview transcript with GTRI and their findings of using the Sf-RVN® Platform.
관련 동영상
Benzonase® 핵산가수분해 효소는 DNA와 RNA를 5개 염기쌍보다 작은 조각으로 효율적으로 절단합니다.
규모 확장에서 규제 장애물 극복, 생산 속도 향상에 이르는 과정입니다.
초기 단계에서부터 플랫폼 공정을 구현하여 유전자 치료 생산 규모를 성공적으로 확장하십시오.
유전자 치료 및 백신의 안전성 프로파일을 개선하십시오.
관련 웨비나
유전자 요법을 위한 AAV 바이러스 벡터 생산은 특유의 업스트림 문제가 있습니다. 머크의 HEK 플랫폼이 이러한 문제를 해결하는 방법에 대해 알아보십시오.
저희가 도와드리겠습니다
문의 사항이 있으시면 고객 지원 요청서를 제출하시거나
또는 당사 고객 서비스 팀에 말씀해 주십시오.
이메일 custserv@sial.com
또는 전화 +1 (800) 244-1173
추가 지원
- 계산기 및 앱
웹 툴박스 - 분석 화학, 생명과학, 화학 합성 및 재료 과학을 위한 과학 연구 도구 및 리소스.
- Customer Support Request
씨그마 알드리치의 주문, 제품, 계정 및 웹사이트에 대해 궁금하신 부분을 확인할 수 있습니다
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
관련 기술 문서
- Adjuvant selection is dependent on vaccine formulation and individual application. Effectiveness and safety are of primary importance in adjuvant selection, yet a number of other characteristics must be considered
- 모두 보기 (0)
더 많은 관련 자료와 프로토콜을 찾아보세요.
업스트림 생산 최적화 및 신뢰할 수 있는 규모 확대를 위한 정화
바이러스 기반 백신 제조를 위해 개발된 업스트림 배양 공정은 생산성 요구 사항 충족을 위해 최적화되어야 합니다. 이 최적화에는 세포 및 세포 잔해 제거와 확실한 바이러스 수확에 필수적인 정화 단계가 포함됩니다. 하지만 업스트림 공정은 예상되는 시장 수요 충족을 위한 안정적 확장이 가능해야만 성공할 수 있습니다.
확실한 불순물 제거로 수율 및 효율 목표 달성
용해된 세포의 핵산은 바이러스 기반 백신 공정에서 일반적인 오염 물질입니다. 규정에서는 전이 숙주 세포 핵산 수준이 약독화 바이러스 기반 백신의 10 ng/dose 이하여야 한다고 요구합니다. Benzonase® 엔도뉴클레아제 치료와 그 후의 접선유동여과는 잔류 핵산 성분을 분해하고 제거하는 견고하고 강력한 조합입니다.
다운스트림 회수 극대화
Benzonase® 엔도뉴클레아제 처리는 농축 및 정용여과 중 대부분의 바이러스 기반 백신 순도 수준을 달성하는 데 충분합니다. 그러나 크로마토그래피는 일본 뇌염 바이러스(JEV) 및 뎅기열바이러스(DENV)와 같은 차세대 바이러스 기반 백신의 순도 목표 달성에 필요합니다. 각 제조 공정은 바이러스 특성에 맞춰 조정되어야 하므로 다운스트림 정제를 위한 툴박스 옵션은 원하는 순도와 최적의 회수를 제공하는 데 필수적입니다.
환자 안전성 보장
바이러스 기반 백신은 약독화 바이러스를 사용해 제조되지만 환자 안전을 유지하는 것은 중요한 문제입니다. 최종 바이러스 백신 벌크는 물과 비교할 수 있습니다. 따라서 백신은 최종 제제 및 충전 단계 전에 0.22µm로 멸균 여과될 수 있습니다.
바이오 공정 액상 세포 배양 배지 및 버퍼
당사는 업계 최고 품질의 멸균 여과 액상 기능을 제공하며 전 세계 GMP 시설에서 바로 사용할 수 있는 세포 배양 배지, 버퍼, CIP 및 SIP 제품을 공급해 바이오의약품 생산을 최적화합니다.

다운스트림 - 접선유동여과(Tangential Flow Filtration, TFF)

최종 멸균 여과 및 충전
충전 마감 요구조건을 간소화하고 현 규제 요건을 준수하는 동시에 제품의 교차 오염 우려를 제거하세요.
관련 자료
- Application Guide: Biopharmaceutical
A search tool to help you overcome your manufacturing challenges.
- Brochure: Vaccine Bioprocessing Handbook
In this handbook, we explain the vaccine production processes and process improvements for all types of vaccine development platforms.
- Mini-Handbook: Cell-Based Vaccine Bioprocessing
Live attenuated viral vaccines can be created using a complex, multi-step cell-based manufacturing process. It is not a templated process. The manufacturing process for each viral vaccine is different.
- e-Book: Enabling Capabilities & Solutions for all Vaccine Platforms
From process development to full-scale GMP-manufacturing, our global vaccine capabilities can help you achieve these goals for all your modalities/platforms including virus-based, subunit, VLP, viral vector, pDNA and mRNA vaccines.
- White Paper: Filtration Strategies for Optimal Development and Purification of a Foot and Mouth Disease Virus
We collaborated with MEVAC to optimize upstream and downstream processes for FMD vaccine manufacturing to establish a scalable, cost-efficient and GMP compliant process. This white paper focuses on the integration of new filtration strategies in both upstream and downstream processes.
- White Paper: Downstream Process Intensification for Virus Purification Using Membrane Chromatography
This white paper provides an overview of the challenges presented by current approaches to virus production and the opportunities to develop a platform approach that can work across different viral modalities and accelerate process development.
- Application Note: Effect of Benzonase® Endonuclease Addition to Purification of Sabin Polio Virus Type 3
This application note summarizes the benefits of incorporating Benzonase® endonuclease in a polio virus type 3 production process.
- Article: Filter-Based Clarification of Viral Vaccines and Vectors
In this article, a comprehensive overview is provided on different filtration technologies and their application in viral vaccine clarification, outlining challenges and present current best practices.
관련 제품
계속 읽으시려면 로그인하거나 계정을 생성하세요.
계정이 없으십니까?











