Przedkliniczne

Testy przedkliniczne wykazują, że docelowy związek wykazuje bezpieczeństwo i skuteczność niezbędne do przejścia do testów na ludziach. Na tym etapie badania in vitro i in vivo mogą trwać kilka lat, a jeśli zakończą się sukcesem, prowadzą do przygotowania i złożenia wniosku o rejestrację nowego leku (Investigational New Drug, IND).
Nagrodzone kategorie
Przeglądaj nasze produkty do hodowli komórkowej, w tym pożywki do hodowli komórkowej, składniki i suplementy do hodowli komórkowej, bioreaktory i filtry oczyszczające.
Zapoznaj się z naszymi rozwiązaniami do przygotowywania buforów i nośników, w tym z naszymi rozwiązaniami Mobius® do jednorazowego mieszania i Mobius® FlexReady.
Usprawnij proces przetwarzania biologicznego: Zapoznaj się z naszą ofertą chromatografii do wydajnego oczyszczania. Żywice, membrany, kolumny i systemy dla każdej skali.
Usługi badań toksykologicznych są niezwykle ważne. Wymagane jest szerokie spektrum badań toksykologicznych in vitro i in vivo, które muszą być zaprojektowane zgodnie z międzynarodowymi wytycznymi i przeprowadzone w pełnej zgodności z przepisami dobrej praktyki laboratoryjnej (GLP).
Uwagi dotyczące rozwoju procesu
- Rozwój linii komórkowych
- Wybór klonów
- Badania przesiewowe mediów i paszy
- Rozwój procesu wyższego szczebla
- Utworzenie głównego banku komórek
- Rozwój procesu w dół
- Rozwój formulacji
- Rozwój i optymalizacja metod analitycznych
- Wsparcie rozwoju procesu analitycznego
- Programy analityczne porównywalności leków biopodobnych
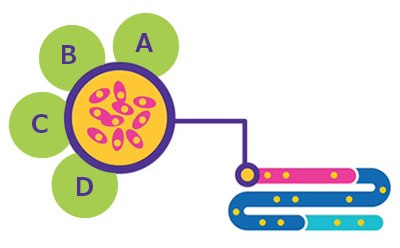
Figure 1.Cell Line Development. A. BioReliance® Product Characterization. B. BioReliance® Cell Banking & Storage. C. BioReliance® Cell Line Development. D. BioReliance® Cell Line Characterization.
Uwagi dotyczące rozwoju linii komórkowych
- Wybór klonu - linie komórkowe, które mogą produkować lek biologiczny w wystarczającym mianie i jakości
- Badania stabilności genetycznej - badania replikujące warunki skalowania
- Stabilność genetyczna - produkcja białka powinna pozostać stabilna przez 60 pokoleń komórek.Badania solidności - badania, które replikują warunki skalowania
- Stabilność genetyczna - produkcja i jakość białka powinny pozostać stabilne po >60 generacjach komórek<
Uwagi dotyczące rozwoju procesu
- Wydajność procesu - eliminacja zbędnych etapów i wykorzystanie zdolności produkcyjnych
- Wydajność procesu - powtarzalność poprzez zwiększanie skali i transfer technologii
- Wydajność finansowa - równoważenie wydajności z kosztami

Uwagi dotyczące technologii
- Elastyczność - sprzęt jednorazowego użytku zwiększa elastyczność, umożliwia tworzenie szablonów i szybką konfigurację zestawów, a także zmniejsza koszty czyszczenia./li>
- Skalowalność - przy wyborze technologii na najwcześniejszych etapach, takich jak skalowanie bioreaktora używanego do hodowli komórek ssaków z 3 L do 200 L do 2000 L<
- Łatwość użycia - rozwiązania obejmują wstępnie zmontowane sterylne ścieżki przepływu procesu; złącza umożliwiające aseptyczne podłączanie, odłączanie i ponowne podłączanie
Uwagi regulacyjne
- Bezpieczeństwo pacjenta - kamienie milowe rozwoju klinicznego muszą oceniać bezpieczeństwo i skuteczność produktu
- Jakość produktu i solidność procesu - rozwiązania obejmują m.in.Jakość produktu i solidność procesu - gromadzenie i analiza danych są niezbędne do potwierdzenia
- Strategia składania wniosków - Znajomość krajów, w których będą dokonywane zgłoszenia, powinna kierować tym, kto przeprowadza inspekcje w zakładzie produkcyjnym
Uwagi biznesowe
- Speed to clinic -
- Speed to clinic -
- dokonywane są duże inwestycje w badania i rozwój, które nie przynoszą zwrotu
- Wydajność procesu - należy aktywnie rozważyć zwiększenie skali, a nie tylko początkową szybkość
- Strategia składania wniosków - należy zidentyfikować, w jaki sposób lek może być wprowadzany do obrotu./b> - zidentyfikuj kraj, w którym należy złożyć wniosek w pierwszej kolejności i szybko uzyskaj dostęp do rynku
Dostęp do odpowiednich zasobów pomaga skupić się na odkryciach o największym potencjale pomocy potrzebującym pacjentom. Wybierz swój etap procesu rozwoju, aby dowiedzieć się więcej lub skorzystaj z linków do produktów i usług, aby znaleźć zasoby.
Odwiedź naszą wyszukiwarkę dokumentów, aby znaleźć arkusze danych, certyfikaty i dokumentację techniczną.
Powiązane artykuły
- The production process developed for new drug candidates is governed by a set of requirements. Emerging biotech companies need to understand and apply these regulations. What is GMP versus non-GMP? What does GLP mean and why is it important to the success of the startup? What does the ICH Q7 guide include?
Zasoby biotechnologiczne
- FDA Investigational New Drug (IND) Application
Explore FDA’s guidance on IND applications, a crucial step in drug development for biotech startups. Navigate regulatory intricacies efficiently.
- Emerging BioTalk Blog
Your gateway to the latest news in biotech. Dive into discussions on market trends, bioprocessing, and technologies for novel modalities. Join the discussion today.
- Brochure: Integrated Bioprocess Solutions
Navigate the path to commercialization with our comprehensive guide for Biopharmaceutical Startups. Accelerate your journey with our range of tools and services.
- Biopharmaceutical Application Guide
Navigate the biopharmaceutical landscape with our application guide, providing resources and solutions for mAb, ADC, and mRNA processes.
Jak możemy pomóc
W przypadku jakichkolwiek pytań, prosimy o przesłanie prośby o wsparcie klienta
lub rozmowę z naszym zespołem obsługi klienta:
Email custserv@sial.com
lub zadzwoń +1 (800) 244-1173
Dodatkowe wsparcie
- Kalkulatory i aplikacje
Web Toolbox - narzędzia naukowe i zasoby dla chemii analitycznej, nauk przyrodniczych, syntezy chemicznej i materiałoznawstwa.
- Customer Support Request
Obsługa klienta, w tym pomoc przy zamówieniach, produktach, kontach i kwestiach technicznych związanych z witryną.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
Przepływ pracy zasobów Biotech Hub


Odkrycie
Identyfikacja czynników, zasobów i wsparcia potrzebnych do opracowania nowego kandydata na lek biologiczny

Faza I-II
Przyspieszenie opracowywania procesów dzięki wskazówkom, szablonom i przewodnikom po aplikacjach

Faza III i produkcja
Postęp od skalowania i transferu technologii do produkcji wysokiej jakości do testów i komercjalizacji

Programy startowe
Połączenie z zasobami i programami grantowymi, które mogą uwolnić potencjał twojej cząsteczki

Regulacyjne
Poruszanie się po jednej z najbardziej regulowanych branż na świecie zaczyna się od zaufanego przewodnika
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?