Poprawa rozpuszczalności koniugatu przeciwciało-lek (ADC) z hydrofobowymi nowymi ładunkami przy użyciu chito-oligosacharydu ChetoSensar™
Koniugaty przeciwciało-lek (ADC) często stanowią wyzwanie dla rozpuszczalności ze względu na hydrofobowe właściwości dołączonych ładunków; słaba rozpuszczalność może prowadzić do agregacji i wpływać na możliwości produkcyjne, a nawet właściwości farmakokinetyczne.
Próbując przezwyciężyć tę hydrofobowość, twórcy ADC mogą uciekać się do zmniejszania stosunku lek-przeciwciało (DAR), co może skutkować utratą skuteczności, zmniejszeniem okna terapeutycznego i powodować niezamierzone skutki uboczne. Inne możliwości złagodzenia wyzwań związanych z rozpuszczalnością są możliwe i obejmują zmiany w formulacji, ładunku lub miejscu koniugacji lub dodanie współrozpuszczalnika.
Niestety, podejścia te wymagają dodatkowych inwestycji, co może zwiększyć ryzyko rozwoju. Jeśli nie uda się rozwiązać problemu rozpuszczalności, program rozwoju klinicznego może zostać zakończony.
Zwiększenie rozpuszczalności dzięki technologii chito-oligosacharydów (ChetoSensar™)
Opracowaliśmy chito-oligosacharyd (ChetoSensar™), który znacznie zwiększa rozpuszczalność ADC po włączeniu do konstrukcji łącznik-ładunek (rysunek 1).
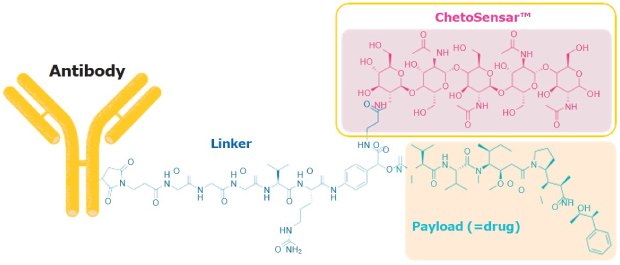
Rysunek 1.ChetoSensar™ dołączony do łącznika wrażliwego na katepsynę B i ładunku monometyloauristatyny E (MMAE).
Rysunek 2 pokazuje zmniejszenie hydrofobowości ADC po włączeniu ChetoSensar™ do konstruktu. Górny panel ilustruje wzrost hydrofobowości DAR 4 ADC w porównaniu do nieskoniugowanego przeciwciała monoklonalnego trastuzumabu (Herceptin). Gdy ten sam DAR 4 ADC ma dołączony ChetoSensar™, obserwuje się znaczące przesunięcie w kierunku nieskoniugowanego przeciwciała, co wskazuje, że właściwości rozpuszczalności ChetoSensar™-ADC są teraz bliższe nieskoniugowanemu przeciwciału, ułatwiając przetwarzanie ADC w fazie rozwoju i produkcji.
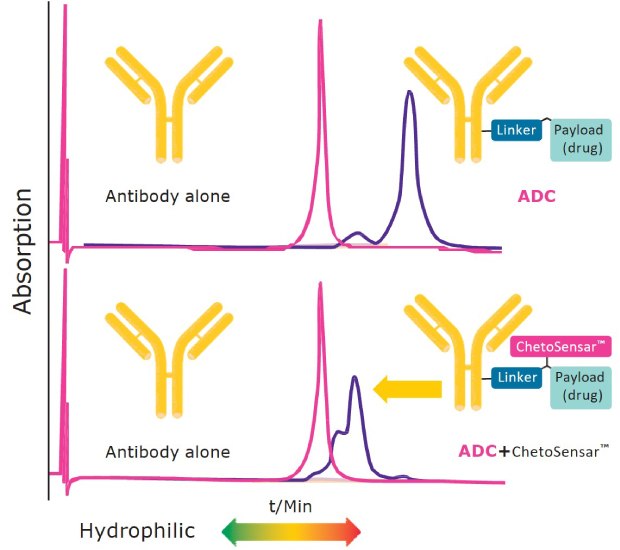
Rysunek 2.. Włączenie ChetoSensar™ do ADC zmniejsza hydrofobowość. Pokazano: chromatogram interakcji hydrofobowej (HIC) z samym przeciwciałem (trastuzumab) i DAR 4 ADC z i bez ChetoSensar™ (ładunkiem jest MMAE).
ChetoSensar™ ADC osiąga regresję guza zbliżoną do wartości wyjściowej
Aby zademonstrować korzyści płynące ze stosowania ChetoSensar™ w konstrukcji ADC, porównano dwa ADC w badaniu in vivo z użyciem ksenograftu SK-OV-3 (rysunek 3). Objętość guza mierzono po podaniu pojedynczej dawki DAR 4 ADC z ChetoSensar™ i bez ChetoSensar™. Wyniki wykazały, że przy równych dawkach, ADC z ChetoSensar™ prowadziło do szybkiej i całkowitej regresji guza do 80 dnia, wskazując na dramatyczny wzrost skuteczności ADC.
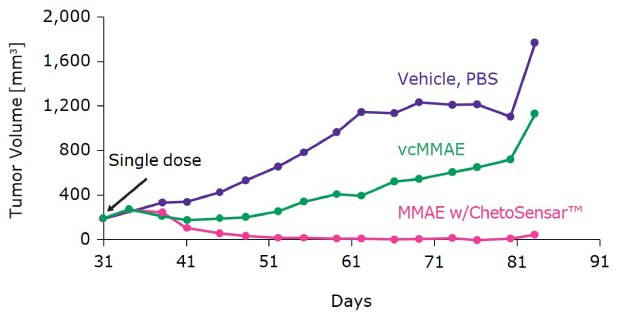
Rysunek 3.ChetoSensar™-ADC osiąga regresję guza zbliżoną do wartości wyjściowej w ksenografie SK-OV-3. Oba ADC są DAR 4 w dawce 6 mg/kg. Pojedyncza dawka rozpoczyna się po 31 dniach. Wszystkie ADC wykorzystują traztuzumab jako modelowy mAb. Mediana wyników pochodzi od grupy ośmiu myszy.
Oprócz skuteczności, tolerancja ADC ma kluczowe znaczenie dla jego sukcesu jako środka terapeutycznego. Jednym ze wskaźników tolerancji jest masa ciała myszy w trakcie badania in vivo. W przypadku ADC obsługujących ChetoSensar™ DAR 4 (rysunek 4A) i DAR 8 (rysunek 4B) nie odnotowano spadku masy ciała, co wskazuje, że ADC ChetoSensar™ były dobrze tolerowane. Ponadto nie zaobserwowano toksyczności ChetoSensar™ poza celem. Nie zaobserwowano zmian histologicznych w żadnym z głównych narządów ani odpowiedzi immunologicznej po dodaniu do komórek jednojądrzastych krwi obwodowej (PBMC), które zostały wyizolowane od trzech różnych dawców (dane nie pokazane).
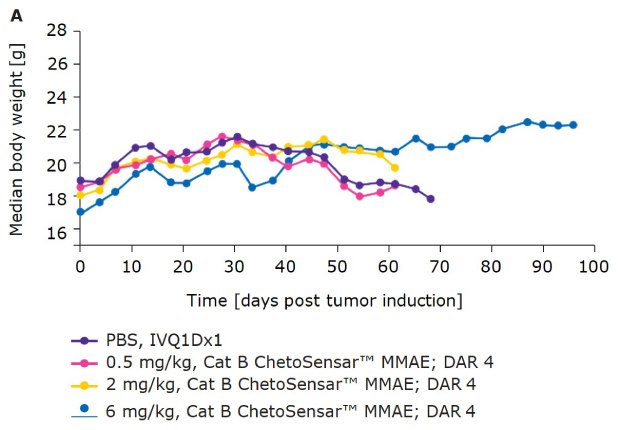
Rysunek 4a.ChetoSensar™-ADC były dobrze tolerowane in vivo z powtarzalnością. Masa ciała myszy w badaniu na zwierzętach DAR 4 ADC z ChetoSensar™. Nie zaobserwowano utraty masy ciała ani skutków ubocznych (np. wysypki skórnej).
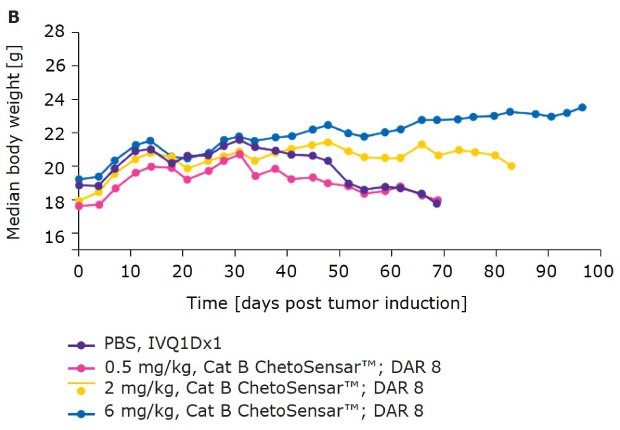
Rysunek 4b.ChetoSensar™-ADC były dobrze tolerowane in vivo z powtarzalnością. Masa ciała myszy w badaniu na zwierzętach DAR 8 ADC z ChetoSensar™. Nie zaobserwowano utraty masy ciała ani skutków ubocznych (np. wysypki skórnej).
Zwiększona skuteczność ADC z ChetoSensar™
Staraliśmy się zdefiniować przyczyny zwiększonej skuteczności ADC z ChetoSensar™. Te ADC zawierają grupę p-aminobenzyloksykarbonylową (PABC), która jest podatna na rozszczepienie katepsyny B (Cat B) w lizosomie. Wykazano, że łączniki PABC ulegają niespecyficznemu klirensowi i utracie ładunku. Jednakże, badania in vitro pokazują, że ChetoSensar™ może działać jako stabilizator przeciwko mysiemu enzymowi karboksyesterazie 1C, gdy jest przyłączony do PABC.
Przeciwciało monoklonalne Herceptin (trastuzumab) w połączeniu z ChetoSensar™ okazało się być stabilne w komórkach mysich i ludzkich bez żadnego niespecyficznego klirensu w oparciu o odpowiednią karboksyesterazę (dane nie pokazane). Wskazuje to, że oprócz poprawy rozpuszczalności, stabilność ADC jest napędzana przez lepszą farmakokinetykę bez negatywnego wpływu na wiązanie przeciwciała.
ChetoSensar™ umożliwia uzyskanie ADC o wyższym stosunku lek-przeciwciało
Następnie stworzyliśmy specyficzny dla miejsca DAR 2 ADC duokarmycyny z ChetoSensar™ i przetestowaliśmy go na humanizowanych myszach FcRn, aby przewidzieć zachowanie in vivo u ludzi (rysunek 5). DAR 2 ChetoSensar™-ADC w roztworze buforowym miał siłę działania w zakresie poniżej nanomolara. Próbki osocza in vivo pobrane po 4 godzinach i 168 godzinach zostały następnie przetestowane na komórkach antygenowo dodatnich i nie wykazały utraty skuteczności. Wskazuje to, że próbki były stabilne przez okres do siedmiu dni w obiegu u humanizowanych myszy FcRn.
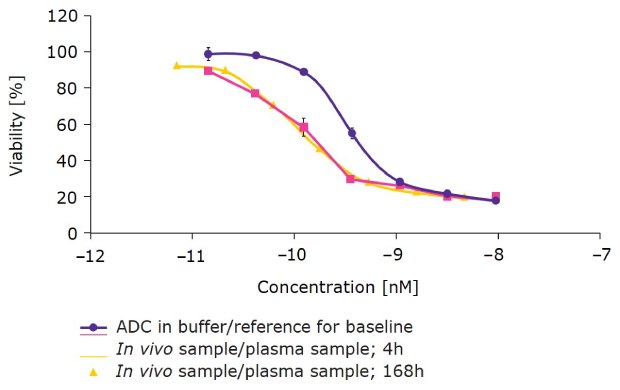
Rysunek 5.ChetoSensar™-duocarmycin ADC (DAR 2) ma korzystną farmakokinetykę u humanizowanych myszy FcRn. Wykazano stabilność ChetoSensar™-ADC bez utraty skuteczności po 7 dniach w komórkach antygenododatnich
Poza przedstawionymi tutaj badaniami DAR 2, ChetoSensar™ umożliwił przygotowanie wolnego od agregatów DAR 8 duokarmycyny ADC, co wcześniej nie było możliwe (rysunek 6). Dotarcie do wyższych gatunków DAR za pomocą technologii ChetoSensar™ daje optymizm co do zwiększonej siły działania również z innymi ładunkami.
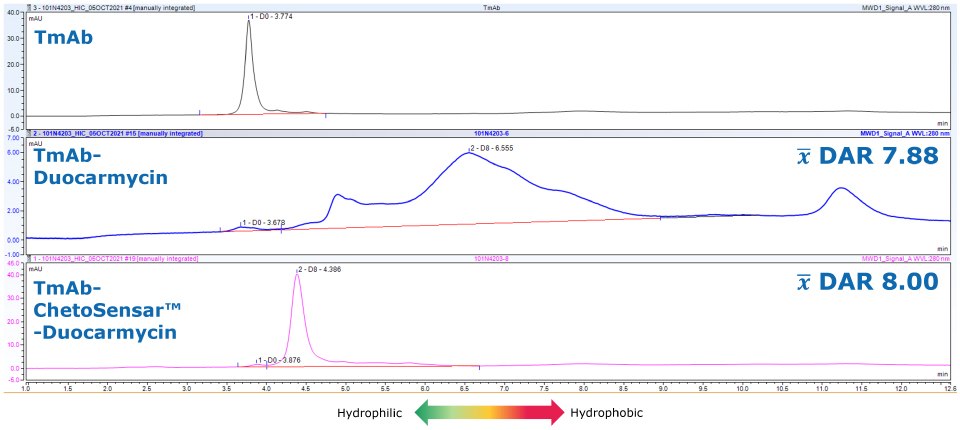
Rysunek 6.ChetoSensar™-duocarmycin ADC nie wykazuje agregacji w HIC w porównaniu do próbki bez ChetoSensar™.
Ten wysoki stopień skuteczności, stabilności i solidnej farmakokinetyki przełożył się również na warunki in vivo. Jak pokazano na rysunku 7, pojedyncza dawka DAR 2 ChetoSensar™-duocarmycin ADC doprowadziła do całkowitej remisji guza w modelu ksenoprzeszczepu bez odrastania do 100 dnia, co stanowi znaczący kontrast w porównaniu z DAR 2 duocarmycin ADC bez ChetoSensar™, który nie miał widocznego wpływu na regresję guza. Trwające badanie z dawką 5 mg/kg również wykazało całkowitą remisję (dane nie pokazane).
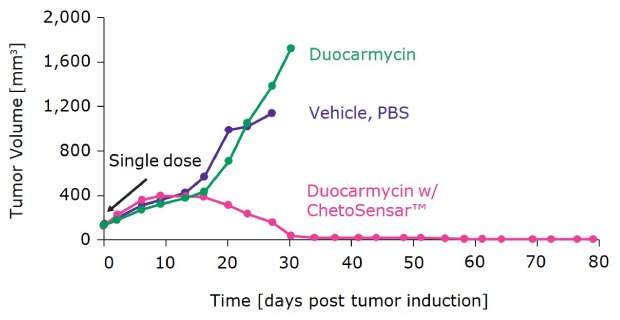
Rysunek 7.Wykazano regresję guza za pomocą DAR 2 ChetoSensar™-duocarmycin ADC. Fioletowy: Pożywka (PBS); zielony: ADC bez ChetoSensar™; różowy: ADC z ChetoSensar™. Oba ADC są podawane w dawce 10 mg/kg; pojedyncza dawka rozpoczyna się w 0 dniu. Konstrukcja ADC wymieniona na rysunku 5.
Rozwiązanie problemu rozpuszczalności ADC
Słaba rozpuszczalność ADC może zagrozić programom rozwojowym. Technologia ChetoSensar™ to innowacyjna opcja pozwalająca sprostać wyzwaniom związanym z rozpuszczalnością. Łącznik chito-oligosacharydowy oferuje dużą elastyczność w zakresie dołączania różnego rodzaju ładunków i wykazano, że działa z różnymi łącznikami, przeciwciałami i metodami koniugacji. Technologia ta zapewnia dostęp do wysoce hydrofobowych, nowych ładunków, które w innym przypadku nie byłyby brane pod uwagę i stwarza możliwość poprawy skuteczności, tolerancji i farmakokinetyki.
Dowiedz się więcej o naszych usługach ADC & Bioconjugation CTDMO.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?