Produzione di vaccini virali
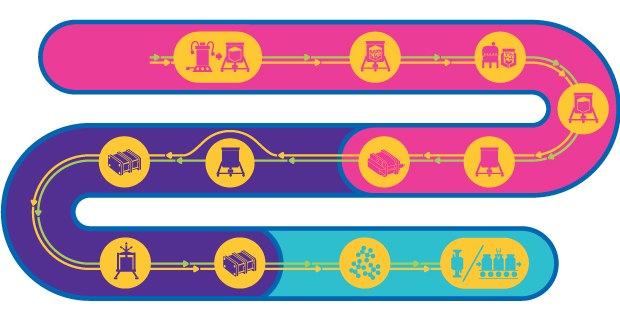
Sequenza del processo produttivo di vaccini a virus inattivati o attenuati
I vaccini virali possono consistere nel virus inattivato, oppure vivo e attenuato. Essi sono in grado di attivare tutte le componenti del sistema immunitario e garantiscono una durevole immunità di lungo termine, suscitando anticorpi neutralizzanti contro il patogeno bersaglio.
Il processo per la produzione di vaccini virali attenuati è complesso; composto da numerose fasi, deve mantenere invariato il potenziale infettivo del virus attenuato. Benché si possa definire un sequenza operativa generica, un approccio standardizzato per la produzione di questi vaccini non esiste. Al contrario, ogni processo è unico e deve essere commisurato a forma, dimensioni, natura, comportamento chimico-fisico, stabilità e specificità della cellula ospite del virus.
Categorie in evidenza
I prodotti chimici di impiego industriale sono un elemento chiave della produzione biofarmaceutica...
I nostri terreni per la coltura di cellule (CCM), sia prodotti in serie, sia customizzati, incrementano la produttività delle fasi upstream per la produzione di mAb, vaccini e terapie geniche/cellulari.
Una soluzione basata sulla trasfezione per la produzione di vettori virali con una linea cellulare in sospensione, terreni chimicamente definiti e un processo con prestazioni comprovate su vasta scala.
Le nostre linee cellulari in pronta consegna e pronte all’uso riducono sensibilmente i tempi, i costi e i rischi associati allo sviluppo di nuove linee cellulari destinate alla produzione. Che produciate anticorpi, proteine ricombinanti o vettori virali per terapie geniche, le nostre piattaforme di linee cellulari possono accelerare il progresso delle fasi upstream.
Il percorso a tappe


Fasi downstream della produzione di vettori virali
Processi di purificazione virale efficienti permettono di migliorare la resa, abbreviare i tempi di immissione in commercio e ridurre i costi di produzione

Formulazione e riempimento finale di vettori virali
Per formulare una terapia genica commercialmente valida sono necessarie competenze applicative e regolatorie di alto livello

Caratterizzazione dei vettori virali e analisi di biosicurezza
Le importantissime analisi di biosicurezza e la caratterizzazione dei vettori virali aiutano a ridurre le problematiche relative alla sicurezza e a migliorare la conoscenza dei prodotti

Sviluppo e produzione conto terzi di vettori virali
Le partnership con le CDMO hanno un ruolo determinante nell’avanzamento delle pipeline cliniche e nella buona riuscita della commercializzazione
Scongelamento ed espansione di cellule e semine
Le cellule congelate provenienti da una master cell bank o una working cell bank vengono scongelate e amplificate per aumentarne il numero prima delle fasi successive del processo.
Preparazione dei terreni e dell'inoculo
I terreni per le colture cellulari vengono ottimizzati con le sostanze nutritive e i supplementi appropriati e portati al pH ideale per farle crescere e produrre virus.
Crescita delle cellule e produzione dei virus
Le cellule vengono fatte crescere in un bioreattore o in un altro ambiente controllato in condizioni specifiche per massimizzare la produzione di virus.
Lisi delle cellule
Nella produzione di AAV, le cellule ospiti vengono lisate chimicamente o meccanicamente cosicché i virus vengano rilasciati nel terreno.
Digestione del DNA
Tutto il DNA indesiderato, ossia quello cellulare e quello plasmidico, viene digerito utilizzando una nucleasi.
Fate una ricerca tra i numerosi documenti disponibili: schede tecniche, certificati e documentazione tecnica.
Articoli correlati
- Scaling up viral vector production using adherent cell culture systems is challenging. Learn how suspension cell culture systems benefit large-scale bioprocessing.
- A step-by-step overview of suspension-based, transient transfection bioreactor process development and scaleup of lentivirus production.
- To address scalability challenges of AAV manufacturing, we developed an HEK293 suspension cell line that can be used across many serotypes. Get the data in this article.
- Visualizza tutto (4)
Documenti correlati
- Product Guide: Upstream Chemicals for Bioprocessing
We offer a broad portfolio of raw materials and chemical components suitable for cell culture media formulations and upstream applications used in biopharmaceutical production.
- White Paper: Application of the Sf-Rhabdovirus-Negative (Sf-RVN®) Platform for AAV Production
The Sf-RVN® Platform is a two-part system comprising a proven Sf-9 cell line devoid of Sf-rhabdovirus (the Sf-RVN® cell line) and a chemically defined medium engineered for the cell line, the EX-CELL® CD Insect Cell Medium.
- Brochure: Gene Therapy Capabilities for AAV and Lentivirus Production
Our products and services for AAV, Lentivirus and other viral vectors provide solutions to your most challenging pain points around process development, speed, manufacturing and regulatory guidelines.
- Transcript: Exploring the Potential of Insect Cell Lines for Efficient AAV Production
Interview transcript with GTRI and their findings of using the Sf-RVN® Platform.
Video correlati
La nucleasi Benzonase® digerisce efficacemente il DNA e l'RNA in frammenti più piccoli di 5 paia di basi.
Dal passaggio di scala al superamento delle lungaggini burocratiche, fino alla produzione.
Applicando sin dall'inizio una strategia di piattaforma al vostro processo, potrete incrementare con successo i volumi produttivi di una terapia genica.
Per migliorare il profilo di sicurezza di terapie geniche e vaccini.
Webinar correlati
La produzione di vettori virali basati su AAV per la terapia genica comporta ostacoli peculiari nelle fasi upstream. Scoprite come la nostra piattaforma con la linea cellulare HEK possa facilitare il superamento di questi ostacoli.
Come possiamo aiutarvi
Per qualunque domanda, non esitate a inviare una richiesta di assistenza
o a chiamare il nostro Servizio Clienti:
Email custserv@sial.com
telefono +1 (800) 244-1173
Altre risorse
- Strumenti di calcolo e app
Strumenti e risorse scientifiche online per la chimica analitica, le life science, la sintesi chimica e la scienza dei materiali.
- Customer Support Request
Assistenza clienti inclusa assistenza per ordini, prodotti, account e problemi tecnici del sito web.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
Articoli tecnici correlati
- Adjuvant selection is dependent on vaccine formulation and individual application. Effectiveness and safety are of primary importance in adjuvant selection, yet a number of other characteristics must be considered
- Visualizza tutto (0)
Cerca altri articoli e protocolli
Ottimizzate la produttività upstream e la chiarificazione con uno scale-up affidabile
I processi upstream basati su colture cellulari per la produzione di vaccini virali devono essere ottimizzati al fine di soddisfare i requisiti di produttività. Questa ottimizzazione comprende anche la fase di chiarifica, essenziale per la rimozione delle cellule e dei frammenti cellulari e per assicurare una robusta raccolta del virus. Tuttavia, il processo upstream può essere definito di successo soltanto se si presta a passaggi di scala affidabili che consentano di anticipare la domanda del mercato.
Raggiungete gli obiettivi di resa ed efficienza con un robusto processo di rimozione delle impurezze
Nei processi per la produzione di vaccini virali, tra i contaminanti più comuni troviamo gli acidi nucleici delle cellule lisate. Per i vaccini a virus attenuato, le norme richiedono che la contaminazione da carry-over di acidi nucleici delle cellule ospiti sia inferiore a 10 ng/dose. Il trattamento con l’endonucleasi Benzonase® seguito da filtrazione a flusso tangenziale è una combinazione robusta e potente per degradare e rimuovere gli acidi nucleici residui.
Massimizzate il recupero nelle fasi downstream
Il trattamento con l’endonucleasi Benzonase® è sufficiente a raggiungere il livello di purezza desiderato durante la concentrazione e la diafiltrazione per la maggior parte dei vaccini virali. Tuttavia, per centrare gli obiettivi di purezza dei vaccini virali di ultima generazione, come quelli contro i virus dell’encefalite giapponese (JEV) e della dengue (DENV), è necessaria una fase di purificazione cromatografica. Poiché ogni processo produttivo deve essere commisurato alle caratteristiche del virus, per raggiungere la purezza desiderata assicurando, nello stesso tempo, un recupero ottimale, è essenziale poter disporre di un’intera gamma di strumenti tra cui scegliere per le purificazioni downstream.
Assicurate la sicurezza dei pazienti
Anche se i vaccini virali vengono prodotti utilizzando virus attenuati, garantire la sicurezza dei pazienti rimane una questione importante. Il bulk finale del vaccino virale è comparabile all’acqua. Pertanto, prima della formulazione finale e delle fasi di riempimento e finitura, il vaccino può essere sterilizzato con filtri sterilizzanti da 0,22 µm.
Trattamento con nucleasi e chiarificazione
Assicurate una scalabilità robusta
- Trattamento con nucleasi Benzonase®, idoneo per una produzione biofarmaceutica EMPROVE® Bio
- Rivelazione della Benzonase® con il kit Elisa Benzonase® II per individuare eventuali residui di enzima nel processo
- filtri di profondità POD Millistak+® HC per la chiarifica primaria/ secondaria
- filtri di profondità Clarisolve® per la chiarifica primaria
- cartucce Polysep II per la chiarifica secondaria
- filtri Milligard® in PES per la chiarifica secondaria
Tamponi e terreni di coltura liquidi per il bioprocesso
Per sostenere al meglio le vostre produzioni biofarmaceutiche, disponiamo di una rete di infrastrutture che producono soluzioni sterili della massima qualità, in grado di fornire terreni di coltura, tamponi, prodotti per CIP e per SIP provenienti da impianti GMP distribuiti in tutto il mondo.

Downstream - Filtrazione a flusso tangenziale
Raggiungete gli obiettivi di resa, efficienza e recupero del virus, assicurando contemporaneamente una robusta rimozione delle impurezze.
- Cassette Pellicon® 2 per ultrafiltrazione/ diafiltrazione
- cassette Pellicon® 3 per ultrafiltrazione/ diafiltrazione
- capsule Pellicon® con membrana Ultracel® per ultrafiltrazione/ diafiltrazione
- sistema Mobius® TFF 80, soluzione Mobius® FlexReady per TFF, sistemi Cogent® Lab e sistema Cogent® per filtrazione a flusso tangenziale su scala di processo
Downstream - Cromatografia
- Resina Eshmuno® Q per cromatografia su membrana
- Membrana cromatografica Natrix® Q Recon Mini per cromatografia su membrana
- Membrana cromatografica Natrix® Q Pilot per cromatografia su membrana
- Resine cromatografiche Fractogel® EMD DEAE per cromatografia per cattura e/o polishing
- Resine cromatografiche Fractogel® EMD DMAE per cromatografia per cattura e/o polishing
- Soluzione Mobius® FlexReady per cromatografia
Inattivazione virale

Prodotti chimici per il processo e formulazione
Filtrazione sterilizzante e riempimento finali
Fugate i timori di contaminazione crociata del prodotto ottimizzando, nello stesso tempo, i requisiti delle fasi di riempimento e finitura nel rispetto delle norme vigenti.
Risorse correlate
- Application Guide: Biopharmaceutical
A search tool to help you overcome your manufacturing challenges.
- Brochure: Vaccine Bioprocessing Handbook
In this handbook, we explain the vaccine production processes and process improvements for all types of vaccine development platforms.
- Mini-Handbook: Cell-Based Vaccine Bioprocessing
Live attenuated viral vaccines can be created using a complex, multi-step cell-based manufacturing process. It is not a templated process. The manufacturing process for each viral vaccine is different.
- e-Book: Enabling Capabilities & Solutions for all Vaccine Platforms
From process development to full-scale GMP-manufacturing, our global vaccine capabilities can help you achieve these goals for all your modalities/platforms including virus-based, subunit, VLP, viral vector, pDNA and mRNA vaccines.
- White Paper: Filtration Strategies for Optimal Development and Purification of a Foot and Mouth Disease Virus
We collaborated with MEVAC to optimize upstream and downstream processes for FMD vaccine manufacturing to establish a scalable, cost-efficient and GMP compliant process. This white paper focuses on the integration of new filtration strategies in both upstream and downstream processes.
- White Paper: Downstream Process Intensification for Virus Purification Using Membrane Chromatography
This white paper provides an overview of the challenges presented by current approaches to virus production and the opportunities to develop a platform approach that can work across different viral modalities and accelerate process development.
- Application Note: Effect of Benzonase® Endonuclease Addition to Purification of Sabin Polio Virus Type 3
This application note summarizes the benefits of incorporating Benzonase® endonuclease in a polio virus type 3 production process.
- Article: Filter-Based Clarification of Viral Vaccines and Vectors
In this article, a comprehensive overview is provided on different filtration technologies and their application in viral vaccine clarification, outlining challenges and present current best practices.
Prodotti correlati
Per continuare a leggere, autenticati o crea un account.
Non hai un Account?











